Tłuszczakomięsak
| liposarcoma | |
 Tłuszczakomięsak śluzowaty | |
| ICD-10 | C49 |
|---|---|
| C49.0 | Tkanka łączna i inne tkanki miękkie głowy, twarzy i szyi |
| C49.1 | Tkanka łączna i inne tkanki miękkie kończyny górnej, łącznie z barkiem |
| C49.2 | Tkanka łączna i inne tkanki miękkie kończyny dolnej, łącznie z biodrem |
| C49.3 | Tkanka łączna i inne tkanki miękkie klatki piersiowej |
| C49.4 | Tkanka łączna i inne tkanki miękkie brzucha |
| C49.5 | Tkanka łączna i inne tkanki miękkie miednicy |
| C49.6 | Tkanka łączna i inne tkanki miękkie tułowia, umiejscowienie nieokreślone |
| C49.8 | Zmiana przekraczająca granice jednego umiejscowienia w obrębie tkanki łącznej i tkanek miękkich |
| C49.9 | Tkanka łączna i inne tkanki miękkie, umiejscowienie nieokreślone |
| ICDO | M8850/3 |
| DiseasesDB | |
| MeSH | |
Tłuszczakomięsak (łac. liposarcoma) – nowotwór złośliwy wywodzący się z adipocytów należący do grupy mięsaków tkanek miękkich. Wyróżnia się kilka podtypów histopatologicznych o dość odmiennej złośliwości, przebiegu klinicznym i typowych miejscach występowania. Tłuszczakomięsak należy do najczęstszych mięsaków tkanek miękkich u dorosłych, które jednak są dość rzadką grupą chorób nowotworowych w tej grupie wiekowej. Najczęstszym objawem nowotworu jest występowanie nieprawidłowej rozprężającej masy, która może zniekształcać kończynę lub pozostawać przez długi okres bezobjawowa w lokalizacji pozaotrzewnowej i wewnętrzbrzusznej. Guz może być rozpoznany na podstawie badań obrazowych, z których najważniejszą rolę pełni rezonans magnetyczny. Biopsja zmiany powinna być wykonywana, jednak w niektórych lokalizacjach często się z niej rezygnuje ze względu na typowy obraz radiologiczny i ograniczoną skuteczność leczenia neoadiuwantowego. Podstawą leczenia jest resekcja zmiany w granicach zdrowych tkanek. Chemioterapia oparta na antracyklinach i radioterapia pełnią pomocniczą rolę w zmianach zaawansowanych lub guzach o dużym ryzyku nawrotu. Rokowanie silnie zależy od typu histopatologicznego nowotworu i możliwości jego chirurgicznego usunięcia.
Typy histopatologiczne
Tłuszczakomięsak może występować w każdej lokalizacji, jednak najczęściej pojawia się w udzie i przestrzeni pozaotrzewnowej[1][2]. Powstaje raczej w głębokich tkankach miękkich oraz trzewiach co odróżnia go od tłuszczaka, który jest nowotworem łagodnym[2]. Stanowi około 20% wszystkich mięsaków tkanek miękkich u dorosłych[1].
Na podstawie cech morfologicznych i mutacji cytogenetycznych wyróżnia się kilka podstawowych typów tłuszczakomięsaka o różnej historii naturalnej i rokowaniu. Wyróżnia się tłuszczakomięsaka dobrze zróżnicowanego (ang. well-differentiated liposarcoma) – inaczej tłuszczaka atypowego (ang. atypical lipomatous tumor) – tłuszczakomięsaka śluzowatego (myxoid liposarcoma), tłuszczakomięsaka odróżnicowanego (dedifferentiated liposarcoma), tłuszczakomięsaka wielopostaciowego (pleomorphic liposarcoma) oraz tłuszczakomięsaka nieokreślonego (mixed-type liposarcoma, liposarcoma not otherwise specifid, liposarcoma NOS)[3].
Tłuszczakomięsak dobrze zróżnicowany
Stanowi 40–45% wszystkich przypadków tłuszczakomięsaka. Jest to guz lokalnie złośliwy, często wytwarzający liczne wznowy miejscowe[4], ale niemal nie daje przerzutów odległych, o ile nie ulegnie odróżnicowaniu[5]. Najczęstszymi lokalizacjami są kończyny (około 40%), tułów (30%) i przestrzeń pozaotrzewnowa (20%), rzadziej pojawia się w klatce piersiowej (5%) i okolicy głowy i szyi (3%)[6]. Makroskopowo jest to duży, dobrze odgraniczony guz o guzkowej powierzchni. Zwykle jest to pojedynczy guz, choć w przestrzeni pozaotrzewnowej może być to kilka guzów. Przybiera kolor od żółtego do białego w zależności od udziału w nim adipocytów, zwłóknienia i obszarów śluzowatych. W dużych guzach mogą występować obszary martwicy tłuszczowej. Mikroskopowo dojrzały tłuszczakomięsak składa się z dojrzałych proliferujących adipocytów ze znacznym zróżnicowaniem wielkości komórek. Ogniskowo jest widoczna atypia jądrowa z nadbarwliwymi (hiperchromatycznymi) jądrami. Komórki te mają tendencję do gromadzenia się w pobliżu przegród łącznotkankowych. Również komórki zrębowe są nadbarwliwe i wielojądrowe. Wiele lipoblastów zawiera pojedyncze lub liczne wakuole w cytoplazmie[7].
Tłuszczakomięsak odróżnicowany
W 10% przypadków tłuszczakomięsak dobrze zróżnicowany ulega odróżnicowaniu[1]. Makroskopowo jest to duży wieloguzkowy guz koloru żółtego zawierający lite obszary o szarym kolorze (obszary odróżnicowania), często ze strefami martwicy i krwotoków[8]. Stopień odróżnicowania jest zmienny. Ryzyko odróżnicowania prawdopodobnie jest większe w zmianach zaotrzewnowych i innych głębokich lokalizacjach w porównaniu do kończyn, gdzie ryzyko wydaje się mniejsze. W 90% odróżnicowaniu ulega tłuszczakomięsak de novo, a tylko w 10% nawrotowy[1][8]. Obok obszarów dobrze zróżnicowany występują obszary nisko zróżnicowanego mięsaka[9]. Obszary odróżnicowane mają zmienny obraz i mogą przypominać niezróżnicowanego mięsaka wielopostaciowego albo pośredniego lub wysokiego stopnia śluzakowłókniakomięsaka (myxofibrosarcoma)[8]. Nowotwór charakteryzuje się bardzo dużą skłonnością do nawrotów, które pojawiają się w 40% przypadków, a w przypadku lokalizacji pozaotrzewnowej niemal zawsze. Przerzuty odległe występują w 20% przypadków[10].
Tłuszczakomięsak śluzowaty i okrągłokomórkowy
Jest to drugi co do częstości typ tłuszczakomięsaka, stanowi 40% przypadków tłuszczakomięsaków[1]. Do grupy zalicza się nowotwór dawniej osobno klasyfikowany jako tłuszczakomięsak okrągłokomórkowy. W 66% przypadków jest zlokalizowany w udzie, znacznie rzadziej w przestrzeni pozaotrzewnowej lub tkance podskórnej[1][11]. Zwykle są to dobrze odgraniczone wieloguzkowe guzy wewnątrzmięśniowe, koloru jasnobrązowego, o galaretowatym przekroju. Guzy są zbudowane z okrągłych lub owalnych prymitywnych mezenchymalnych komórek z wczesnych etapów lipogenezy i zmiennej liczby małych sygnetowatych lipoblastów w śluzowatym zrębie z charakterystycznym wzorem unaczynienia[1][12][11].
Nowotwór często wykazuje skłonność do nawrotów lokalnych i u 33% chorych dochodzi do powstawania przerzutów odległych, co jest zależne od stopnia złośliwości histologicznej. Ten typ mięsaka ma tendencje do tworzenia przerzutów i wieloogniskowych nowotworów synchronicznych lub metachronicznych (pojawienie się nowego ogniska nowotworu w pewnym odstępie od rozpoznania ogniska pierwotnego)[11][13][14][15]. Przerzuty i nowotwory synchroniczne mają tendencję do pojawiania się w nietypowych miejscach w obrębie tkanek miękkich z dużą zawartością tkanki tłuszczowej (przeciwna kończyna, pacha, przestrzeń zaotrzewnowa) oraz kości, szczególnie do kręgosłupa, a dopiero w drugiej kolejności pojawiają się przerzuty do płuc[11][16][13][17]. Odróżnienie choroby synchronicznej od przerzutowej jest bardzo trudne i jest możliwe tylko poprzez dokładną analizę różnorodności cytogenetycznej komórek nowotworowych[13].
Tłuszczakomięsak wielopostaciowy (polimorficzny, pleomorficzny)
Jest to mięsak o dużym stopniu złośliwości. Zlokalizowany jest głównie w głębokich tkankach miękkich w obrębie kończyn, częściej w kończynie dolnej niż górnej. Rzadziej występuje w tułowiu, przestrzeni pozaotrzewnowej, śródpiersiu, skalpie, w okolicy jąder i oczodole. Stanowi poniżej 5% wszystkich typów tłuszczakomięsaków[18][16]. Makroskopowo często jest to twardy, wieloogniskowy, duży guz o średnicy nawet powyżej 10 cm o kolorze białym do żółtego. W wielu przypadkach występują strefy martwicy lub śluzowate obszary[19]. Mogą być guzami dobrze odgraniczonymi lub naciekającymi. Mikroskopowo jest zbudowany z różnej liczby polimorficznych lipoblastów w tle do wielopostaciowego mięsaka. Zwykle nowotwór składa się z wrzecionowatych komórek nowotworowych o wielu postaciach oraz pęczków wrzecionowatych i okrągłych komórek przemieszanych z wielojądrzastymi gigantycznymi komórkami (podobnymi do komórek niezróżnicowanego mięsaka pleomorficznego – UPS). Również może składać się z polimorficznych, wielowodniczkowych lipoblastów z dziwacznymi, hiperchromatycznymi, półokrągłymi jądrami. Często są widoczne wewnątrzkomórkowe lub zewnątrzkomórkowe eozynofilne kropelki, rzadko występuje naciek zapalny[19][20]. Choć ten typ tłuszczakomięsaka zawiera wielopostaciowe lipoblasty, to brak wysoko zróżnicowanych składników tłuszczakowatych odróżnia go od typu odróżnicowanego[9]. Klinicznie bardzo często występują przerzuty, które dotyczą aż 50% chorych. Początkowo lokalizują się w płucach[16].
Tłuszczakomięsak nieokreślony
Jest to guz wykazujący jednocześnie cechy tłuszczakomięsaka śluzowatego, okrągłokomórkowego, dobrze zróżnicowanego, odróżnicowanego i polimorficznego. Ten typ nowotworu dotyczy głównie osób starszych. Pojawia się najczęściej w przestrzeni zaotrzewnowej lub jamie brzusznej, a rzadziej w obrębie kończyn. Makroskopowo jest dużym zielonożółtym wieloogniskowym guzem zawierającym torbielowate i lite obszary[21]. Mikroskopowo charakteryzuje się występowaniem obszarów śluzowatych, które pozwalają odróżnić go od tłuszczakomięsaka dobrze zróżnicowanego, szczególnie w lokalizacji wewnątrzbrzusznej lub zaotrzewnowej, w której tłuszczakomięsak śluzowaty występuje rzadziej. Faktycznie typowo powstaje w wyniku zwyrodnienia śluzowatego lub odróżnicowanie tłuszczakomięsaka dobrze zróżnicowanego z cechami podobnymi do śluzakowłókniakomięsaka (myxofibrosarcoma-like dedifferentiated liposarcoma)[21].
Epidemiologia
Jest to rzadki nowotwór dotyczący przede wszystkim ludzi dorosłych pomiędzy 50 a 65 rokiem życia. Stanowi przynajmniej 20% mięsaków tkanek miękkich u osób dorosłych[1]. Zapadalność na tłuszczakomięsaka wynosi 6 przypadków na milion[22]. Szczytowa częstość występowania przypada na czwartą i piątą dekadę życia, choć rzadko może pojawiać się około dwudziestego roku życia[11]. Tłuszczakomiesak śluzowaty częściej dotyczy ludzi młodych. Podtyp wielopostaciowy (pleomorficzny) dotyczy przede wszystkim ludzi powyżej 50 roku życia[16]. U dzieci jest to rzadki nowotwór, gdyż stanowi od 2% do 3% wszystkich mięsaków tkanek miękkich, przy czym najczęstszym podtypem jest tłuszczakomięsak śluzowaty stanowiący 90% przypadków tłuszczakomięsaka u dzieci[23][24].
Objawy
Objawy są uzależnione od lokalizacji i histologicznego typu guza. Zwykle są to zmiany bezbolesne i długo bezobjawowe. Często są one głęboko zlokalizowane i mogą osiągać spore rozmiary. Szczególnie duże guzy mogą występować w przestrzeni zaotrzewnowej, gdzie nierzadko przekraczają 20 cm średnicy. W literaturze są opisywane przypadki guzów o masie nawet 20–40 kg w tej lokalizacji[25][26][27]. Szacuje się, że 20% guzów w momencie rozpoznania ma wielkość przekraczającą 10 cm[27][28]. Często są wykrywane przypadkowo[4]. Guzy wewnątrzbrzuszne powodują ściśnięcie narządów jamy brzusznej, co powoduje powstawanie nieokreślonego uczucia dyskomfortu w brzuchu, utratę masy ciała, a w przypadku dużych guzów znaczne zniekształcenie brzucha[27]. Tłuszczakomięsak śluzowaty zwykle występuje jako duży bezbolesny guz w głębokich tkankach miękkich kończyn, często powodując powstanie widocznego i macalnego guza[11]. Długa historia choroby i niedawny szybki wzrost guza, który najłatwiej zaobserwować na kończynach, sugerują tłuszczakomięsaka odróżnicowanego[8]. Tłuszczakomięsak wielopostaciowy objawia się jako twarda rozprężająca masa, często stwierdza się krótką historię choroby[18].
Rozpoznanie
Tłuszczakomięsak, podobnie jak inne mięsaki jest wykrywany w badaniach obrazowych, z których największą rolę pełni rezonans magnetyczny (MRI). Ponadto, w przeciwieństwie do innych mięsaków tkanek miękkich, rozpoznanie tłuszczakomięsaka może być postawione poprzez badania obrazowe[29][30].
Badania obrazowe
Badaniem obrazowym mającym największe znaczenie dla postawienia rozpoznania tłuszczakomięsaka jest rezonans magnetyczny, a mniejszą przydatność wykazuje tomografia komputerowa (TK)[29][30]. Ta druga technika znajduje zastosowanie w diagnostyce przerzutów w płucach oraz zmian w przestrzeni pozaotrzewnowej, gdzie jej skuteczność jest porównywalna do rezonansu magnetycznego[31]. Do wstępnej diagnostyki może być stosowana ultrasonografia (USG)[31].
Tłuszczakomięsak dobrze zróżnicowany w rezonansie magnetycznym na ogół przypomina tkankę tłuszczową, podczas gdy guzy o niskim zróżnicowaniu są zmianami beztłuszczowymi[9]. Tłuszczakomięsak dobrze zróżnicowany przybiera formę słabo unaczynionego guza o intensywności sygnału odpowiadającemu tkance tłuszczowej, z grubymi przegrodami łącznotkankowymi zawierającymi guzkowate elementy nietłuszczowe[32][33][30]. W rezonansie magnetycznym w obrazach T1-zależnych wykazuje niski lub pośredni sygnał i wysoki sygnał w obrazach T2-zależnych. Zwykle guz jest dobrze odgraniczony[30].
Tłuszczakomięsak śluzowaty z powodu mniejszego odsetka tkanki tłuszczowej, charakteryzuje się dużą zawartością wody w tkankach guza, co jest wykrywalne w MRI, TK i USG. Wykrycie niewielkiej ilości tkanki tłuszczowej w przegrodach lub niewielkich zmianach ogniskowych umożliwia rozpoznanie 80–95% przypadków guza[32]. W tłuszczakomięsaku śluzowatym obraz zależy od ilości tkanki tłuszczowej, materiału śluzowatego, stopnia komórkowości, unaczynienia i martwicy. Tłuszczakomięsak śluzowaty w MRI w obrazach T1-zależnych zwykle wykazuje niski sygnał i obraz może zawierać w mniejszej proporcji wysoki sygnał[34]. W guzie występują koronkowe, linearne lub bezpostaciowe ogniska tkanki tłuszczowej[35]. W części z tych guzów w obrazie T1-zależnym nie uwidaczniają się strefy tłuszczowe i w tych guzach w obrazach T2-zależnych jest obserwowany homogenny lub heterogenny wysoki sygnał[34]. Przegrody mogą dawać słaby sygnał w obrazie T2-zależnym. Po podaniu kontrastu gadolinowego następuje wzmocnienie obrazu guza[35]. Guz jest dobrze odgraniczony[34].
Tłuszczakomięsak odróżnicowany typowo zawiera składniki o obrazie tłuszczakomięsaka dobrze zróżnicowanego oraz ogniskowe nietłuszczowe masy. Granice guza mogą być dobrze lub słabo odgraniczone. Guzy posiadają heterogenny lub mieszany niski, pośredni lub wysoki sygnał w obrazach T1 i T2-zależnych. W części nietłuszczowej mogą być widoczne krwotoki lub martwica. Po podaniu środka cieniującego guzy wykazują wybitne wzmocnienie kontrastowe o heterogennym wzorze[34]. Występowanie dominującej ogniskowej zmiany powyżej 1 cm w tłuszczakomięsaku dobrze zróżnicowanym sugeruje odróżnicowany tłuszczakomięsak[32].
Tłuszczakomięsak wielopostaciowy jest widoczny jako zmiany mięsakowate o wysokiem stopniu zróżnicowania, z niewielkimi ilościami tkanki tłuszczowej, które w 60–75% przypadków umożliwiają rozpoznanie[32]. Często są widoczne ogniska krwotoczne i martwica[9]. Cechują się mieszanym niskim, pośrednim lub wysokim sygnałem w obrazach T1 i T2-zależnych[34]. Po podaniu kontrastu guzy wykazują wybitne wzmocnienie kontrastowe o heterogennym wzorze[34].
Zmiany cytogenetyczne
Tłuszczakomięsak dobrze zróżnicowany oraz odróżnicowany[20] charakteryzuje się występowaniem dodatkowego chromosomu pierścieniowego, który powstaje z amplifikowanego regionu 12q14-15[1][12], występuje on w 80% przypadków[36]. Region zawiera geny MDM2 oraz CDK4 – białka MDM2 i CDK4 mogą być przydatne w diagnostyce tłuszczakomięsaka dobrze zróżnicowanego i odróżnicowanego[37][38][39]. Również nadekspresja genu p16 może być przydatna w diagnostyce różnicowej tych guzów[38].
W 90–95% przypadków tłuszczakomięsaka śluzowatego i okrągłokomórkowego występuje translokacja t(12;16)(q13-14;p11), w wyniku której dochodzi do połączenia genów CHOP (DDIT3) oraz TLS (FUS), w rezultacie ekspresji połączonych genów powstaje hybrydowe białko CHOP-TLS (FUS-DDIT3), będące czynnikiem transkrypcyjnym, i które zwiększa zdolność przyłączania kinazy CDK2 do białek cytoszkieletu[13][40][41][36][42][16]. Jest to bardzo czuły i swoisty marker tłuszczakomięsaka śluzowatego i okrągłokomórkowego[16]. Obecność translokacji t(12;16)(q13-14;p11) prawdopodobnie nie ma wpływu na rokowanie[41]. Rzadziej występuje translokacja t(12;22)(q13;q12), która prowadzi do fuzji genów DDIT3 i EWSR1. W jej wyniku dochodzi do produkcji białka fuzyjnego DDIT3-EWSR1[43][44][45].
W tłuszczakomięsaku wielopostaciowym obserwuje się wiele różnych zmian cytogenetycznych. Najczęstszymi aberracjami są dodatkowe regiony 20q13 (90% guzów), 5p13-p15 (70%), 17p11.2-p12 (65%) 1q21-q22 (57%), 9q22 (57%), 1p21 (50%), 6p21 (50%), 6q23-q24 (50%), a rzadziej 7p15, 7p22, 7q11, 7q22, 12q24, 22q13, 17q25 oraz delecje regionów 12p13 (50%), 13q21 (43%), 11q22-q23 i 13q14[46][47].
Biopsja
Biopsja jest standardowym postępowaniem po stwierdzeniu zmiany mogącej odpowiadać mięsakowi. Wykonuje się biopsję gruboigłową z wielu miejsc guza, a przy niewielkich zmianach powierzchniowych biopsję wycinającą. Biopsja cienkoigłowa nie jest zalecana[31]. Biopsja może spowodować niedoszacowanie złośliwości histologicznej nowotworu[31]. Jednak większość pozaotrzewnowych guzów jest rozpoznawana za pomocą badań obrazowych bez wykonania biopsji, ponieważ chemioterapia lub radioterapia neoadiuwantowa prawdopodobnie nie jest skuteczna. Powinna być wykonana, gdy guz przestrzeni zaotrzewnowej zawierający tłuszcz prawdopodobnie nie będzie możliwy do całkowitej resekcji lub wykazuje podobieństwo do naczyniakomięśniakotłuszczaka. Biopsja jest częściej wykonywana w zmianach zlokalizowanych w kończynach, w których stosuje się neoadiuwantową chemioterapię[29]. Biopsja powinna być zaplanowana w taki sposób, aby jej przebieg w tkankach i blizna mogły być usunięte podczas zabiegu chirurgicznego usuwającego guza[31].
Leczenie
Chirurgia onkologiczna
Całkowita chirurgiczna resekcja guza jest najskuteczniejszą metodą postępowania w chorobie zlokalizowanej[48]. Zakres resekcji jest uzależniony od lokalizacji guza i jego typu histopatologicznego[45]. Standardowo stosuje się szerokie wycięcie z zakresie zdrowych tkanek (tzw. mikroskopowo ujemny margines chirurgiczny – resekcje R0)[31]. Sama wielkość marginesu resekcji jest uzależniona od podtypu histopatologicznego. Makroskopowo ujemne marginesy resekcji (resekcje R0 i R1) są osiągane u 80% leczonych[49][50].
Tłuszczakomięsak dobrze zróżnicowany w obrębie kończyn najczęściej jest leczony za pomocą procedur oszczędzających kończynę przed amputacją. Powinien być zachowany margines wynoszący przynajmniej 1–2 cm[45][29]. Jeśli ten margines nie jest możliwy z powodu bezpośredniego przylegania do pęczka naczyniowo-nerwowego lub kości to guz należy dokładnie usunąć z nienaruszoną powięzią, pochewką powrózka naczyniowo-nerwowego lub okostną. Jeśli tłuszczakomięsak dobrze zróżnicowany otacza powrózek naczyniowo-nerwowy może być konieczna resekcja struktur[29]. Miąższ nerki rzadko jest zajęty przez nowotwór i w przypadku jej naciekania usunięcie powięzi nerki jest wystarczające[51]. W przypadku braku ujemnych mikroskopowo marginesów (resekcja R1) należy rozważyć reoperację ośrodkach referencyjnych, a w przypadku resekcji bez zachowanych makroskopowo ujemnych marginesów (resekcja R2) reoperacja jest obligatoryjna[31].
Bardzo istotna jest lokalna kontrola choroby, szczególnie przy podtypach dobrze zróżnicowanych, które rzadziej tworzą przerzuty. W przeciwieństwie do lokalizacji w kończynach, w przypadku mięsaków zlokalizowanych w obrębie jamy brzusznej i tułowia większość zgonów następuje w efekcie niekontrolowanej wznowy miejscowej i uszkodzenia sąsiednich istotnych życiowo narządów, a nie w konsekwencji powstawania przerzutów odległych[48]. W guzach na kończynach zgony są rzadsze i zwykle są skutkiem wytworzenia się przerzutów. Jeśli resekcja radykalna nie jest możliwa, to wykonuje się resekcje cytoredukcyjne, które mogą zmniejszyć nasilenie objawów, ryzyko powikłań oraz wydłużyć przeżycie[52]. Nie ma konsensusu co do skuteczności powtarzanych operacji cytoredukcyjnych[53]. Jednak w niektórych ośrodkach referencyjnych często wykonuje się reoperacje, ponieważ uważa się, że nawet niekompletne reoperacje mogą złagodzić objawy i prawdopodobnie wydłużyć przeżycie[48][51].
Radioterapia
W leczeniu mięsaków tkanek miękkich radioterapia jest standardowym postępowaniem po szerokiej resekcji głębokich guzów o wielkości powyżej 5 cm i wysokiej złośliwości histologicznej (G2-G3). Często również głębokie zmiany o wysokiej złośliwości histologicznej, ale wielkości mniejszej niż 5 cm są leczone radioterapią, mimo braku konsensusu co do skuteczności tego leczenia[31]. Lokalna kontrola choroby oraz przeżycie nie zależą od harmonogramu radioterapii, a od wystąpienia wczesnych lub późnych powikłań. Gdy przewiduje się, że powikłania rany operacyjnej będą problematyczne – lepszym rozwiązaniem jest radioterapia adiuwantowa, niż neoadiuwantowa, którą można rozważyć, gdy nie przewiduje się powikłań chirurgicznych[31].
Jednak zastosowanie radioterapii w leczeniu tłuszczakomięsaka jest kontrowersyjne, choć są pewne dowody na skuteczność radioterapii adiuwantowej, która może pomóc w lokalnej kontroli choroby[54]. Znajduje ona zastosowanie głównie w leczeniu guzów zaotrzewnowych lub wewnątrzbrzusznych oraz w zmianach o niskiej złośliwości na kończynach. Radioterapia kończyn może umożliwić operację zachowującą kończynę, chroniąc ją przed amputacją[55] oraz poprawia wskaźnik lokalnej kontroli guza w tej lokalizacji[56][57][58].
Korzyści z adiuwantowej radioterapii w guzach pozaotrzewnowych i w jamie brzusznej nie są wystarczająco udokumentowane. Część badań wskazuje na redukcję ryzyka wznowy i polepszenie kontroli lokalnej choroby[56][59][60]. W przypadku tłuszczakomięsaka dobrze zróżnicowanego w lokalizacji pozaotrzewnowej wykorzystanie radioterapii nie jest uzasadnione, ponieważ jej stosowanie znacząco podnosi chorobowość leczonych[61]. Prawdopodobnie otrzymanie przedoperacyjnej radioterapii nie jest korzystne dla chorych nawet w sytuacji pooperacyjnych dodatnich marginesów[62][54]. Tłuszczakomięsak śluzowaty najlepiej odpowiada na radioterapię[16][63] i radioterapia może być stosowana, gdy istnieją przerzuty odległe. Radioterapia może być skuteczną metodą paliatywnego leczenia przerzutów tłuszczakomięsaka śluzowatego[54].
Radioterapia może być zalecana jako leczenie paliatywne, gdy resekcja nie jest możliwa[64][65][66].
Chemioterapia
Chemioterapia adiuwantowa i neoadiuwantowa
Kilka badań wskazuje na pewną skuteczność chemioterapii neoadiuwantowej lub adiuwantowej w tłuszczakomięsaku śluzowatym[67][68]. Jednak metaanaliza z 2008 roku sugeruje brak wpływu tej terapii na przeżycie[69]. Prawdopodobnie największe korzyści w chemioterapii neoadiuwantowej lub adiuwantowej uzyskują chorzy na tłuszczakomięsaka śluzowatego w młodym wieku o wysokim ryzyku nawrotu[70].
Chemioterapia w chorobie z przerzutami
W zaawansowanej chorobie nowotworowej z przerzutami stosuje się chemioterapię. Poszczególne typu tłuszczakomięsaka znacząco różnią się wrażliwością na cytostatyki. Zgodnie z wytycznymi ESMO (European Society for Medical Oncology) w leczeniu mięsaków tkanek miękkich, w tym tłuszczakomięsaka, stosuje się chemioterapię opartą na antracyklinach, głównie doksorubicynę[31].
Doksorubicyna z połączeniu z ifosfamidem jest skuteczna w leczeniu tłuszczakomięsaka śluzowatego, w którym odsetek odpowiedzi w badaniu klinicznym wynosił 48% w porównaniu z 18% odsetkiem odpowiedzi dla pozostałych typów tego nowotworu[67]. Również inne badania wskazują na jego skuteczność[70]. Jest to zalecane połączenie, gdy pozwala na to stan ogólny leczonego i guz wykazuje odpowiedź na te połączenie[31].
W leczeniu tłuszczakomięsaka śluzowatego skuteczna jest również trabektedyna[70][71][72], która według zaleceń ESMO jest lekiem drugiego rzutu w leczeniu tego podtypu tłuszczakomięsaka[31].
W tłuszczakomięsaku dobrze zróżnicowanym podaje się doksorubicynę w monoterapii, która charakteryzuje się około 12% odsetkiem odpowiedzi. Połączenie doksorubicyny z innymi cytostatykami, w tym ifosfamidem, prawdopodobnie podnosi odsetek odpowiedzi, jednak nie obserwuje się wzrostu przeżycia[73].
Połączenie gemcytabiny i docetakselu jest związane w niewielkimi odpowiedziami w odróżnicowanym tłuszczakomięsaku[70].
W przypadku braku zgody chorego na okaleczającą operację w obrębie kończyn lub nieoperacyjnego guza opcją terapeutyczną może być izolowana perfuzja kończyny z interferonem α i melfalanem[31].
Zaawansowanie kliniczne
Zaawansowanie tłuszczakomięsaka jest oceniane w klasyfikacji TNM dla mięsaków tkanek miękkich.
| Guz pierwotny – cecha T | |
| Tx | nie można ocenić guza pierwotnego |
| T0 | nie stwierdza się guza pierwotnego |
| T1 | guz mniejszy lub równy 5 cm |
| T1a | powierzchniowy guz |
| T1b | głęboki guz |
| T2 | guz powyżej 5 cm |
| T2a | powierzchniowy guz |
| T2b | głęboki guz |
| Zajęcie okolicznych węzłów chłonnych – cecha N | |
| Nx | nie można ocenić okolicznych węzłów chłonnych |
| N0 | nie stwierdza się przerzutów w okolicznych węzłach chłonnych |
| N1 | przerzuty obecne w węzłach chłonnych |
| Przerzuty odległe – cecha M | |
| M0 | nie stwierdza się przerzutów odległych |
| M1 | obecne przerzuty odległe |
| Stopień złośliwości histologicznej | ||||
| Stopień | G1 | G2 | G3 | |
| Punkty | 2–3 | 4–5 | 6–8 | |
| Kryteria | ||||
| Punkty | 0 | 1 | 2 | 3 |
| Zróżnicowanie guza | – | wysokie | pośrednie | niskie |
| Martwica | brak | <50% | >50% | – |
| Indeks mitotyczny | – | <10 | 10–19 | >20 |
| Stopień zaawansowania | Cecha T | Cecha N | Cecha M | Cecha G |
| IA | T1a, T1b | N0 | M0 | Gx, G1 |
| IB | T2a, T2b | N0 | M0 | Gx, G1 |
| IIA | T1a, T1b | N0 | M0 | G2, G3 |
| IIB | T2a, T2b | N0 | M0 | G2 |
| III | T2a, T2b | N0 | M0 | G3 |
| każde T | N1 | M0 | każde G | |
| IV | każde T | każde N | M1 | każde G |
Rokowanie
Tłuszczakomięsak cechuje się stosunkowo dobrym rokowaniem w porównaniu do innych mięsaków tkanek miękkich u dorosłych[50][74]. Najlepszym rokowaniem charakteryzuje się tłuszczakomięsak dobrze zróżnicowany i śluzowaty, które mają niski wskaźnik występowania przerzutów[25]. Typ odróżnicowany i wielopostaciowy charakteryzuje się znacznie gorszym rokowaniem[56].
Czynnikami rokowniczymi są: typ histologiczny guza, wieloogniskowość nowotworu, kompletność resekcji oraz zachowanie integralności guza podczas resekcji. Chorzy z niekompletną resekcją (R2) guza wykazują znacząco gorsze wskaźniki przeżycia[49]. Dla guzów w obrębie tułowia wielkość guza powyżej 5 cm jest niekorzystnym czynnikiem rokowniczym, jednak w lokalizacji pozaotrzewnowej wielkość guza nie jest czynnikiem prognostycznym[74]. Średnia mediana przeżycia całkowitego wynosi około 60–83 miesięcy[48][75][76], a pięcioletnie przeżycie swoiste dla choroby około 60%[48].
Rokowanie w tłuszczakomięsaku dobrze zróżnicowanym silnie zależy od jego lokalizacji, która decyduje o możliwości szerokiego wycięcia guza[33]. Ryzyko nawrotu tłuszczakomięsaka dobrze zróżnicowanym w kończynach wynosi 40%, w tułowiu 70%, a w przestrzeni pozaotrzewnowej aż 90%, co jest związane z trudnościami w uzyskaniu ujemnych marginesów wycięcia[33]. Jednak w typie dobrze zróżnicowanym samo przeżycie całkowite (OS) nie wykazuje znaczących różnic w różnych lokalizacjach i wynosi około 115 miesięcy, przy czym jednocześnie pięcioletnie przeżycie swoiste dla choroby (DSS) jest znacząco gorsze w lokalizacji pozaotrzewnowej. Pięcioletnie przeżycie swoiste dla choroby wynosi w lokalizacji w kończynach 98%, w tułowiu 93% i w przestrzeni pozaotrzewnowej 87%[6].
W typie śluzowatym i okrągłokomórkowym do czynników ryzyka należą: wiek powyżej 45 lat[77], duży guz powyżej 10 cm[13], odsetek typu okrągłokomórkowego powyżej 5%[78][79][80] i obecność martwicy nowotworu[77][41]. Nowotwór wieloogniskowy charakteryzuje znacząco gorsze rokowanie[15][79][81]. W typie śluzowatym nie zawierającym stref z okrągłych komórek przeżycie pięcioletnie osiąga około 70–90% chorych[56][1]. W zmianach zawierających odsetek typu okrągłokomórkowego powyżej 5% przeżycia pięcioletnie są znacznie gorsze i osiąga je około 50% chorych[1].
Typ odróżnicowany charakteryzuje się około 50% odsetkiem przeżyć pięcioletnich[56]. Typ wielopostaciowy rokuje źle. Często dochodzi do rozwoju przerzutów odległych i chorzy często umierają w krótkim czasie od rozpoznania[16]. Odsetek przeżyć pięcioletnich wynosi około 40%[56].
Tłuszczakomięsak u zwierząt
Tłuszczakomięsak został opisany u licznych zwierząt domowych[82][83][84] i dzikich[85][86][87][88].
Podejrzanie mięsaka jest stawiane na podstawie badania klinicznego oraz biopsji z badaniem cytologicznym. Ostateczne rozpoznanie jest stawiane na podstawie badania histopatologicznego[83][84][89]. Leczenie polega na możliwie radykalnym zabiegu chirurgicznym lub postępowaniu paliatywnym[82][89][90]. Przy nieradykalnym zabiegu bywa stosowana radioterapia i chemioterapia, jednak ich skuteczność jest nieokreślona[91][84][82]. Podobnie jak u ludzi ryzyko nawrotu zależy od stopnia radykalności zabiegu, lokalizacji i wielkości guza oraz stopnia złośliwości histologicznej guza[84][92].
Historia
Mięsaki po raz pierwszy zostały wydzielone jako osobna grupa nowotworów przez Rudolfa Virchowa[93]. Jako pierwszy podał on opis tłuszczakomięsaka w 1857 roku[94]. W 1916 roku H.E. Robertson zebrał serię 50 przypadków tego nowotworu[95][96]. W 1935 roku James Ewing rozszerzył kryteria diagnostyczne tego nowotworu[97]. W 1969 roku WHO opublikowała pierwszą wersję zasad klasyfikacji mięsaków. Obecnie obowiązująca, trzecia wersja tej klasyfikacji, została wydana w 2002 roku[97].
Przypisy
- ↑ a b c d e f g h i j k DeVita, Lawrence i Rosenberg 2008 ↓, s. 1751.
- ↑ a b Vinay Kumar, Ramzi S. Cotran, Stanley L. Robins: Robins Patologia. Wrocław: Elsevier Urban & Partner, 2005, s. 894. ISBN 83-89581-92-2.
- ↑ Anna Nasierowska-Guttmejer, Barbara Górnicka: Zalecenia do diagnostyki histopatologicznej nowotworów. Warszawa: Centrum Onkologii, Oddział Gliwice; Polskie Towarzystwo Patologów, 2013, s. 350. ISBN 978-83-909137-1-1.
- ↑ a b Fletcher, Unni i Mertens 2002 ↓, s. 35.
- ↑ A. Forus, M.L. Larramendy, L.A. Meza-Zepeda, B. Bjerkehagen i inni. Dedifferentiation of a well-differentiated liposarcoma to a highly malignant metastatic osteosarcoma: amplification of 12q14 at all stages and gain of 1q22-q24 associated with metastases. „Cancer Genet Cytogenet”. 125 (2), s. 100–111, Mar 2001. PMID: 11369052.
- ↑ a b C.A. Smith, S.R. Martinez, W.H. Tseng, R.M. Tamurian i inni. Predicting survival for well-differentiated liposarcoma: the importance of tumor location. „J Surg Res”. 175 (1), s. 12–17, Jun 2012. DOI: 10.1016/j.jss.2011.07.024. PMID: 21920555.
- ↑ Fletcher, Unni i Mertens 2002 ↓, s. 35–36.
- ↑ a b c d Fletcher, Unni i Mertens 2002 ↓, s. 38.
- ↑ a b c d G.S. Campbell, T.J. Lawrence, S.E. Porter, L. Rezeanu. Primary dedifferentiated liposarcoma of the axilla arising in a mixed, well-differentiated and myxoid liposarcoma. „J Radiol Case Rep”. 6 (1), s. 9–16, Jan 2012. DOI: 10.3941/jrcr.v6i1.867. PMID: 22690275.
- ↑ Fletcher, Unni i Mertens 2002 ↓, s. 39.
- ↑ a b c d e f Fletcher, Unni i Mertens 2002 ↓, s. 40.
- ↑ a b Piotr Rutkowski, Zbigniew I. Nowecki: Mięsaki tkanek miękkich u dorosłych. Warszawa: Medical Tribune Polska, 2009. ISBN 978-83-601-3569-3.
- ↑ a b c d e N. Asano, M. Susa, S. Hosaka, R. Nakayama i inni. Metastatic patterns of myxoid/round cell liposarcoma: a review of a 25-year experience. „Sarcoma”. 2012, s. 345161, 2012. DOI: 10.1155/2012/345161. PMID: 22550416.
- ↑ S.L. Blair, J.J. Lewis, D. Leung, J. Woodruff i inni. Multifocal extremity sarcoma: an uncommon and controversial entity. „Ann Surg Oncol”. 5 (1). s. 37–40. PMID: 9524706.
- ↑ a b N.S. Salemis, C. Seretis, F. Seretis, C. Christofyllakis i inni. Metachronous multifocal myxoid liposarcoma involving the gastrointestinal tract. Management and literature review. „J Nat Sci Biol Med”. 5 (1), s. 186–190, Jan 2014. DOI: 10.4103/0976-9668.127325. PMID: 24678225.
- ↑ a b c d e f g h DeVita, Lawrence i Rosenberg 2008 ↓, s. 1752.
- ↑ S.H. Estourgie, G.P. Nielsen, M.J. Ott. Metastatic patterns of extremity myxoid liposarcoma and their outcome. „J Surg Oncol”. 80 (2), s. 89–93, Jun 2002. DOI: 10.1002/jso.10093. PMID: 12173385.
- ↑ a b Fletcher, Unni i Mertens 2002 ↓, s. 44.
- ↑ a b Fletcher, Unni i Mertens 2002 ↓, s. 44–45.
- ↑ a b K.A. Downes, J.R. Goldblum, E.A. Montgomery, C. Fisher. Pleomorphic liposarcoma: a clinicopathologic analysis of 19 cases. „Mod Pathol”. 14 (3), s. 179–184, Mar 2001. DOI: 10.1038/modpathol.3880280. PMID: 11266523.
- ↑ a b Fletcher, Unni i Mertens 2002 ↓, s. 46.
- ↑ National Cancer Intelligence Network, [www.ncin.org.uk/view?rid=2062 Soft Tissue Sarcoma Incidence and Survival Tumours Diagnosed in England Between 1985 and 2009], 2012.
- ↑ Schneider i in. 2012 ↓, s. 498–499.
- ↑ W.W. Huh, C. Yuen, M. Munsell, A. Hayes-Jordan i inni. Liposarcoma in children and young adults: a multi-institutional experience. „Pediatr Blood Cancer”. 57 (7), s. 1142–1146, Dec 2011. DOI: 10.1002/pbc.23095. PMID: 21394894.
- ↑ a b M.R. Akhoondinasab, M. Omranifard. Huge retroperitoneal liposarcoma. „J Res Med Sci”. 16 (4), s. 565–567, Apr 2011. PMID: 22091275.
- ↑ A. Herrera-Gómez, C. Ortega-Gutiérrez, A.M. Betancourt, K. Luna-Ortiz. Giant retroperitoneal liposarcoma. „World J Surg Oncol”. 6, s. 115, 2008. DOI: 10.1186/1477-7819-6-115. PMID: 18976464.
- ↑ a b c C. Shahaji, P. Amit, P. Prashant, T. Sachin. Giant retroperitoneal liposarcoma: a case report. „Case Rep Oncol Med”. 2012, s. 869409, 2012. DOI: 10.1155/2012/869409. PMID: 23227387.
- ↑ K. Inoue, Y. Higaki, H. Yoshida. Giant retroperitoneal liposarcoma. „Int J Urol”. 12 (2), s. 220–222, Feb 2005. DOI: 10.1111/j.1442-2042.2005.01019.x. PMID: 15733122.
- ↑ a b c d e A.M. Crago, S. Singer. Clinical and molecular approaches to well differentiated and dedifferentiated liposarcoma. „Curr Opin Oncol”. 23 (4), s. 373–378, Jul 2011. DOI: 10.1097/CCO.0b013e32834796e6. PMID: 21552124.
- ↑ a b c d Meyers 2011 ↓, s. 555–556.
- ↑ a b c d e f g h i j k l m n o p P.G. Casali, J.Y. Blay, A. Bertuzzi, S. Bielack i inni. Soft tissue and visceral sarcomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. „Ann Oncol”. 25 Suppl 3, s. iii102-12, Sep 2014. DOI: 10.1093/annonc/mdu254. PMID: 25210080.
- ↑ a b c d M.D. Murphey, L.K. Arcara, J. Fanburg-Smith. From the archives of the AFIP: imaging of musculoskeletal liposarcoma with radiologic-pathologic correlation. „Radiographics”. 25 (5). s. 1371–1395. DOI: 10.1148/rg.255055106. PMID: 16160117.
- ↑ a b c R. Costea, E. Vasiliu, N.O. Zarnescu, M. Hasouna i inni. Large thigh liposarcoma--diagnostic and therapeutic features. „J Med Life”. 4 (2), s. 184–188, May 2011. PMID: 21776304.
- ↑ a b c d e f Meyers 2011 ↓, s. 556.
- ↑ a b M.S. Sung, H.S. Kang, J.S. Suh, J.H. Lee i inni. Myxoid liposarcoma: appearance at MR imaging with histologic correlation. „Radiographics”. 20 (4). s. 1007–1019. DOI: 10.1148/radiographics.20.4.g00jl021007. PMID: 10903690.
- ↑ a b C.D. Fletcher, M. Akerman, P. Dal Cin, I. de Wever i inni. Correlation between clinicopathological features and karyotype in lipomatous tumors. A report of 178 cases from the Chromosomes and Morphology (CHAMP) Collaborative Study Group. „Am J Pathol”. 148 (2), s. 623–630, Feb 1996. PMID: 8579124.
- ↑ P.B. Aleixo, A.A. Hartmann, I.C. Menezes, R.T. Meurer i inni. Can MDM2 and CDK4 make the diagnosis of well differentiated/dedifferentiated liposarcoma? An immunohistochemical study on 129 soft tissue tumours. „J Clin Pathol”. 62 (12), s. 1127–1135, Dec 2009. DOI: 10.1136/jcp.2009.070201. PMID: 19946100.
- ↑ a b K. Thway, R. Flora, C. Shah, D. Olmos i inni. Diagnostic utility of p16, CDK4, and MDM2 as an immunohistochemical panel in distinguishing well-differentiated and dedifferentiated liposarcomas from other adipocytic tumors. „Am J Surg Pathol”. 36 (3), s. 462–469, Mar 2012. DOI: 10.1097/PAS.0b013e3182417330. PMID: 22301498.
- ↑ M.B. Binh, X. Sastre-Garau, L. Guillou, G. de Pinieux i inni. MDM2 and CDK4 immunostainings are useful adjuncts in diagnosing well-differentiated and dedifferentiated liposarcoma subtypes: a comparative analysis of 559 soft tissue neoplasms with genetic data. „Am J Surg Pathol”. 29 (10), s. 1340–1347, Oct 2005. PMID: 16160477.
- ↑ C. Bento, M.K. Andersson, P. Aman. DDIT3/CHOP and the sarcoma fusion oncoprotein FUS-DDIT3/TLS-CHOP bind cyclin-dependent kinase 2. „BMC Cell Biol”. 10, s. 89, 2009. DOI: 10.1186/1471-2121-10-89. PMID: 20017906.
- ↑ a b c C.R. Antonescu, S.J. Tschernyavsky, R. Decuseara, D.H. Leung i inni. Prognostic impact of P53 status, TLS-CHOP fusion transcript structure, and histological grade in myxoid liposarcoma: a molecular and clinicopathologic study of 82 cases. „Clin Cancer Res”. 7 (12), s. 3977–3987, Dec 2001. PMID: 11751490.
- ↑ G. Tallini, M. Akerman, P. Dal Cin, I. De Wever i inni. Combined morphologic and karyotypic study of 28 myxoid liposarcomas. Implications for a revised morphologic typing (a report from the CHAMP Group). „Am J Surg Pathol”. 20 (9), s. 1047–1055, Sep 1996. PMID: 8764741.
- ↑ K. Engström, H. Willén, C. Kåbjörn-Gustafsson, C. Andersson i inni. The myxoid/round cell liposarcoma fusion oncogene FUS-DDIT3 and the normal DDIT3 induce a liposarcoma phenotype in transfected human fibrosarcoma cells. „Am J Pathol”. 168 (5), s. 1642–1653, May 2006. DOI: 10.2353/ajpath.2006.050872. PMID: 16651630.
- ↑ I. Panagopoulos, N. Mandahl, F. Mitelman, P. Aman. Two distinct FUS breakpoint clusters in myxoid liposarcoma and acute myeloid leukemia with the translocations t(12;16) and t(16;21). „Oncogene”. 11 (6), s. 1133–1137, Sep 1995. PMID: 7566973.
- ↑ a b c Brennan, Antonescu i Maki 2012 ↓, s. 99.
- ↑ R.J. Rieker, S. Joos, C. Bartsch, F. Willeke i inni. Distinct chromosomal imbalances in pleomorphic and in high-grade dedifferentiated liposarcomas. „Int J Cancer”. 99 (1), s. 68–73, May 2002. PMID: 11948494.
- ↑ L. Guillou, A. Aurias. Soft tissue sarcomas with complex genomic profiles.. „Virchows Arch”. 456 (2), s. 201–217, Feb 2010. DOI: 10.1007/s00428-009-0853-4. PMID: 20217954.
- ↑ a b c d e J.O. Park, L.X. Qin, F.P. Prete, C. Antonescu i inni. Predicting outcome by growth rate of locally recurrent retroperitoneal liposarcoma: the one centimeter per month rule. „Ann Surg”. 250 (6), s. 977–982, Dec 2009. PMID: 19953716.
- ↑ a b E.Z. Keung, J.L. Hornick, M.M. Bertagnolli, E.H. Baldini i inni. Predictors of outcomes in patients with primary retroperitoneal dedifferentiated liposarcoma undergoing surgery. „J Am Coll Surg”. 218 (2), s. 206–217, Feb 2014. DOI: 10.1016/j.jamcollsurg.2013.10.009. PMID: 24315890.
- ↑ a b M. Fiore, F. Grosso, S. Lo Vullo, E. Pennacchioli i inni. Myxoid/round cell and pleomorphic liposarcomas: prognostic factors and survival in a series of patients treated at a single institution. „Cancer”. 109 (12), s. 2522–2531, Jun 2007. DOI: 10.1002/cncr.22720. PMID: 17510918.
- ↑ a b Brennan, Antonescu i Maki 2012 ↓, s. 100.
- ↑ R. Blanken, S. Meijer, M.A. Cuesta, C.E. Blomjous. Retroperitoneal sarcomas: pre-operative assessment and surgical therapy. „Neth J Surg”. 43 (6), s. 245–248, 1991. PMID: 1812419.
- ↑ W. Lu, J. Lau, M.D. Xu, Y. Zhang i inni. Recurrent abdominal liposarcoma: analysis of 19 cases and prognostic factors. „World J Gastroenterol”. 19 (25), s. 4045–4052, Jul 2013. DOI: 10.3748/wjg.v19.i25.4045. PMID: 23840151.
- ↑ a b c Brennan, Antonescu i Maki 2012 ↓, s. 104.
- ↑ I. De Wever, M. Stas: Lipomatous Tumors: Diagnosis and Primary Treatment. Leuven University Press, 1997, s. 139–140. ISBN 978-90-6186-798-2.
- ↑ a b c d e f H.S. Kim, J. Lee, S.Y. Yi, H.J. Jun i inni. Liposarcoma: exploration of clinical prognostic factors for risk based stratification of therapy. „BMC Cancer”. 9, s. 205, 2009. DOI: 10.1186/1471-2407-9-205. PMID: 19558664.
- ↑ P.W. Pisters, L.B. Harrison, J.M. Woodruff, J.J. Gaynor i inni. A prospective randomized trial of adjuvant brachytherapy in the management of low-grade soft tissue sarcomas of the extremity and superficial trunk. „J Clin Oncol”. 12 (6), s. 1150–1155, Jun 1994. PMID: 8201376.
- ↑ J.C. Yang, A.E. Chang, A.R. Baker, W.F. Sindelar i inni. Randomized prospective study of the benefit of adjuvant radiation therapy in the treatment of soft tissue sarcomas of the extremity. „J Clin Oncol”. 16 (1), s. 197–203, Jan 1998. PMID: 9440743.
- ↑ C.N. Catton, B. O’Sullivan, C. Kotwall, B. Cummings i inni. Outcome and prognosis in retroperitoneal soft tissue sarcoma. „Int J Radiat Oncol Biol Phys”. 29 (5), s. 1005–1010, Jul 1994. PMID: 8083069.
- ↑ M.J. Heslin, J.J. Lewis, E. Nadler, E. Newman i inni. Prognostic factors associated with long-term survival for retroperitoneal sarcoma: implications for management. „J Clin Oncol”. 15 (8), s. 2832–2839, Aug 1997. PMID: 9256126.
- ↑ Brennan, Antonescu i Maki 2012 ↓, s. 103.
- ↑ R.S. de Vreeze, D. de Jong, R.L. Haas, F. Stewart i inni. Effectiveness of radiotherapy in myxoid sarcomas is associated with a dense vascular pattern. „Int J Radiat Oncol Biol Phys”. 72 (5), s. 1480–1487, Dec 2008. DOI: 10.1016/j.ijrobp.2008.03.008. PMID: 18448271.
- ↑ P.W. Chung, B.M. Deheshi, P.C. Ferguson, J.S. Wunder i inni. Radiosensitivity translates into excellent local control in extremity myxoid liposarcoma: a comparison with other soft tissue sarcomas. „Cancer”. 115 (14), s. 3254–3261, Jul 2009. DOI: 10.1002/cncr.24375. PMID: 19472403.
- ↑ DeVita, Lawrence i Rosenberg 2008 ↓, s. 1770.
- ↑ K. Khanfir, L. Alzieu, P. Terrier, C. Le Péchoux i inni. Does adjuvant radiation therapy increase loco-regional control after optimal resection of soft-tissue sarcoma of the extremities?. „Eur J Cancer”. 39 (13), s. 1872–1880, Sep 2003. PMID: 12932665.
- ↑ C.H. Song, F.Y. Chai, M.F. Saukani, H. Singh i inni. Management and prevention of recurrent paratesticular liposarcoma. „Malays J Med Sci”. 20 (4), s. 95–97, Jul 2013. PMID: 24044004.
- ↑ a b R.L. Jones, C. Fisher, O. Al-Muderis, I.R. Judson. Differential sensitivity of liposarcoma subtypes to chemotherapy. „Eur J Cancer”. 41 (18), s. 2853–2860, Dec 2005. DOI: 10.1016/j.ejca.2005.07.023. PMID: 16289617.
- ↑ Shreyaskumar R. Patel i inni, Myxoid liposarcoma. Experience with chemotherapy, „Cancer”, 74 (4), 1994, s. 1265–1269, DOI: 10.1002/1097-0142(19940815)74:4<1265::aid-cncr2820740414>3.0.co;2-x, PMID: 8055448.
- ↑ N. Pervaiz, N. Colterjohn, F. Farrokhyar, R. Tozer i inni. A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. „Cancer”. 113 (3), s. 573–581, Aug 2008. DOI: 10.1002/cncr.23592. PMID: 18521899.
- ↑ a b c d Brennan, Antonescu i Maki 2012 ↓, s. 105.
- ↑ F. Grosso, R. Sanfilippo, E. Virdis, C. Piovesan i inni. Trabectedin in myxoid liposarcomas (MLS): a long-term analysis of a single-institution series. „Ann Oncol”. 20 (8), s. 1439–1444, Aug 2009. DOI: 10.1093/annonc/mdp004. PMID: 19465423.
- ↑ G.D. Demetri, S.P. Chawla, M. von Mehren, P. Ritch i inni. Efficacy and safety of trabectedin in patients with advanced or metastatic liposarcoma or leiomyosarcoma after failure of prior anthracyclines and ifosfamide: results of a randomized phase II study of two different schedules. „J Clin Oncol”. 27 (25), s. 4188–4196, Sep 2009. DOI: 10.1200/JCO.2008.21.0088. PMID: 19652065.
- ↑ A. Italiano, M. Toulmonde, A. Cioffi, N. Penel i inni. Advanced well-differentiated/dedifferentiated liposarcomas: role of chemotherapy and survival. „Ann Oncol”. 23 (6), s. 1601–1607, Jun 2012. DOI: 10.1093/annonc/mdr485. PMID: 22039081.
- ↑ a b S. Singer, J.M. Corson, G.D. Demetri, E.A. Healey i inni. Prognostic factors predictive of survival for truncal and retroperitoneal soft-tissue sarcoma. „Ann Surg”. 221 (2), s. 185–195, Feb 1995. PMID: 7857146.
- ↑ J.J. Lewis, D. Leung, J.M. Woodruff, M.F. Brennan. Retroperitoneal soft-tissue sarcoma: analysis of 500 patients treated and followed at a single institution. „Ann Surg”. 228 (3), s. 355–365, Sep 1998. PMID: 9742918.
- ↑ D.P. Jaques, D.G. Coit, S.I. Hajdu, M.F. Brennan. Management of primary and recurrent soft-tissue sarcoma of the retroperitoneum. „Ann Surg”. 212 (1), s. 51–59, Jul 1990. PMID: 2363604.
- ↑ a b S.E. Kilpatrick, J. Doyon, P.F. Choong, F.H. Sim i inni. The clinicopathologic spectrum of myxoid and round cell liposarcoma. A study of 95 cases. „Cancer”. 77 (8), s. 1450–1458, Apr 1996. PMID: 8608528.
- ↑ T.A. Smith, K.A. Easley, J.R. Goldblum. Myxoid/round cell liposarcoma of the extremities. A clinicopathologic study of 29 cases with particular attention to extent of round cell liposarcoma. „Am J Surg Pathol”. 20 (2), s. 171–180, Feb 1996. PMID: 8554106.
- ↑ a b A.J. Spillane, C. Fisher, J.M. Thomas. Myxoid liposarcoma-the frequency and the natural history of nonpulmonary soft tissue metastases. „Ann Surg Oncol”. 6 (4), s. 389–394, Jun 1999. PMID: 10379861.
- ↑ J. Haniball, V.P. Sumathi, L.G. Kindblom, A. Abudu i inni. Prognostic factors and metastatic patterns in primary myxoid/round-cell liposarcoma. „Sarcoma”. 2011, s. 538085, 2011. DOI: 10.1155/2011/538085. PMID: 22190864.
- ↑ C.R. Antonescu, A. Elahi, J.H. Healey, M.F. Brennan i inni. Monoclonality of multifocal myxoid liposarcoma: confirmation by analysis of TLS-CHOP or EWS-CHOP rearrangements. „Clin Cancer Res”. 6 (7), s. 2788–2793, Jul 2000. PMID: 10914725.
- ↑ a b c Wallace B. Morrison: Cancer in Dogs and Cats: Medical and Surgical Management. Teton NewMedia, 2002, s. 480. ISBN 978-1-893441-47-7.
- ↑ a b Yonca Betil Kabak, Cenk Yardimci, Semra Okur-Gumusova, Mustafa Yavuz Gulbahar. Myxoid liposarcoma in a cat. „Ankara Üniv Vet Fak”, 2011.
- ↑ a b c d S. Gardhouse, D. Eshar, J. Fromstein, D.A. Smith. Diagnosis and successful surgical treatment of an unusual inguinal liposarcoma in a pet ferret (Mustela putorius furo). „Can Vet J”. 54 (8), s. 739–742, Aug 2013. PMID: 24155472.
- ↑ H. Kondo, S.C. Wickins, J.A. Conway, M.F. Mallicote i inni. Cranial mediastinal liposarcoma in a horse. „Vet Pathol”. 49 (6), s. 1040–1042, Nov 2012. DOI: 10.1177/0300985811432348. PMID: 22287648.
- ↑ H. Shive, F. Mohammed, J. Osterstock, B. Porter i inni. Liposarcoma in the nasal cavity of a cow. „Vet Pathol”. 43 (5), s. 793–797, Sep 2006. DOI: 10.1354/vp.43-5-793. PMID: 16966465.
- ↑ G. Doria-Torra, J. Martínez, M. Domingo, B. Vidaña i inni. Liposarcoma in animals: Literature review and case report in a domestic pig (Sus scrofa). „J Vet Diagn Invest”. 27 (2), s. 196–202, Mar 2015. DOI: 10.1177/1040638714567190. PMID: 25613042.
- ↑ S.M. Mohiddin, K. Ramakrishna. Liposarcoma in a fowl. „Avian Dis”. 16 (3), s. 680–684, May-Jun 1972. PMID: 5038661.
- ↑ a b J.F. Quinton, F. Ollivier, C. Dally. A case of well-differentiated palpebral liposarcoma in a Guinea pig (Cavia porcellus). „Vet Ophthalmol”. 16 Suppl 1, s. 155–159, Jul 2013. DOI: 10.1111/vop.12042. PMID: 23621115.
- ↑ C.A. Kuntz, W.S. Dernell, B.E. Powers, C. Devitt i inni. Prognostic factors for surgical treatment of soft-tissue sarcomas in dogs: 75 cases (1986–1996). „J Am Vet Med Assoc”. 211 (9), s. 1147–1151, Nov 1997. PMID: 9364229.
- ↑ M.M. Dennis, K.D. McSporran, N.J. Bacon, F.Y. Schulman i inni. Prognostic factors for cutaneous and subcutaneous soft tissue sarcomas in dogs. „Vet Pathol”. 48 (1), s. 73–84, Jan 2011. DOI: 10.1177/0300985810388820. PMID: 21139143.
- ↑ J.L. Baez, M.J. Hendrick, F.S. Shofer, C. Goldkamp i inni. Liposarcomas in dogs: 56 cases (1989–2000). „J Am Vet Med Assoc”. 224 (6), s. 887–891, Mar 2004. PMID: 15070059.
- ↑ James S. Olson: The History of Cancer: An Annotated Bibliography. Greenwood Press Inc., 1989, s. 269–272. ISBN 0-313-25889-9.
- ↑ Y.B. Kim, D.H. Leem, J.A. Baek, S.O. Ko. Atypical lipomatous tumor/well-differentiated liposarcoma of the gingiva: a case report and review of literature. „J Oral Maxillofac Surg”. 72 (2), s. 431–439, Feb 2014. DOI: 10.1016/j.joms.2013.06.222. PMID: 23992781.
- ↑ Franz M. Enzinger, Donald J. Winslow, Liposarcoma, „Virchows Archiv für pathologische Anatomie und Physiologie und für klinische Medizin”, 1962.
- ↑ A.F. Bernard Shaw, [Embryonal cell liposarcoma, „The Journal of Pathology and Bacteriology”, 2005, DOI: 10.1002/path.1700430206.
- ↑ a b Clinical and molecular studies of liposarcoma, 2007.
Bibliografia
- Vincent T. DeVita, Theodore S. Lawrence, Steven A. Rosenberg: Devita, Hellman & Rosenberg’s Cancer: Principles & Practice of Oncology. Wyd. 8. Lippincott Williams & Wilkins, 2008. ISBN 978-0-7817-7207-5.
- Christopher D.M. Fletcher, K. Krishnan Unni, Fredrik Mertens, Pathology and Genetics of Tumours of Soft Tissue and Bone, Lyon: IARC Press, 2002 [dostęp 2018-11-16] [zarchiwizowane z adresu 2018-11-16].
- Murray F. Brennan, Cristina R. Antonescu, Robert G. Maki: Management of Soft Tissue Sarcoma. Springer Science & Business Media, 2012.
- Steven P. Meyers: MRI of Bone and Soft Tissue Tumors and Tumorlike Lesions: Differential Diagnosis and Atlas. Thieme, 2011. ISBN 978-1-58890-251-1.
- Dominik T. Schneider, Ines B. Brecht, Thomas A. Olson, Andrea Ferrari: Rare Tumors In Children and Adolescents. Springer Science & Business Media, 2012. ISBN 978-3-642-04197-6.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Unklekrappy, Licencja: CC0
Left thigh showing edema caused by liposarcoma
Rudolf Virchow
Autor: LWozniak&KWZielinski, Licencja: CC BY-SA 3.0
Tłuszczakomięsak wielopostaciowy
- Skupisko dużych, atypowych komórek z obfitą cytoplazmą zawierającą tłuszcz. Jądra tych komórek charakteryzują się dyskariozą i monstrualnymi jąderkami.
Autor: Autor nie został podany w rozpoznawalny automatycznie sposób. Założono, że to KGH (w oparciu o szablon praw autorskich)., Licencja: CC-BY-SA-3.0
Histopathologic image of myxoid liposarcoma arising in the deep soft tissue of the thigh. H & E stain. The same case as shown in a file "Myxoid_liposarcoma_(1).jpg".
Autor: Panoraia Paraskeva, Paraskevas Katsaronis, Eleftherios D Spartalis, Andreas C Lazaris, Hara Gakiopoulou, Panagiotis Mallis and Periklis Tomos, Licencja: CC BY-SA 2.0
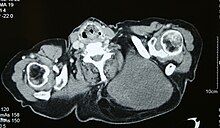
87 year old man with a liposarcoma. Chest CT-scan.
Autor: LWozniak&KWZielinski, Licencja: CC BY-SA 3.0
Tłuszczakomięsak śluzowaty
- Guz jest utworzony przez atypowe lipoblasty, czasem wielojądrowe, nieregularnie rozsiane w śluzowato zmienionym podścielisku.
Autor: LWozniak&KWZielinski, Licencja: CC BY-SA 3.0
Tłuszczak wielopostaciowy (pleomorficzny)
- Guz składa się z różnej wielkości adipocytów porozdzielanych tkanką łączną. Ze względu na obecność atypowych lipoblastów bywa niekiedy określany mianem "wysoko zróżnicowanego tłuszczakomięsaka" (ang. well differentiated lipoma-like liposarcoma)
Autor: Nephron, Licencja: CC BY-SA 3.0
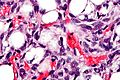
High magnification micrograph of a dedifferentiated liposarcoma. H&E stain.