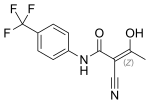Teryflunomid
| |||||||||||||||||||
| |||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||
| Wzór sumaryczny | C12H9F3N2O2 | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 270,21 g/mol | ||||||||||||||||||
| Identyfikacja | |||||||||||||||||||
| Numer CAS | |||||||||||||||||||
| PubChem | |||||||||||||||||||
| DrugBank | |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||
| ATC | |||||||||||||||||||
| |||||||||||||||||||
Teryflunomid – wielofunkcyjny organiczny związek chemiczny, aktywny metabolit leflunomidu[3]. Jest środkiem immunomodulującym o właściwościach przeciwzapalnych. Stosowany w leczeniu stwardnienia rozsianego.
Wskazania
Jest wskazany w leczeniu dorosłych pacjentów ze stwardnieniem rozsianym o przebiegu rzutowo-ustępującym[4] i jest kwalifikowany jako lek pierwszego wyboru w leczeniu tej choroby[5].
Skuteczność
Stosowany raz na dobę w dawce 14 mg dobę powoduje zmniejszenie częstości rzutów o ok. 30% i obniżenie ryzyka progresji niewydolności ruchowej o 30% w skali roku[6]. W badaniach MRI wykazano, że leczenie teryflunomidem, w porównaniu z podawaniem placebo, powoduje zmniejszenie całkowitej objętości nowych zmian o 69% oraz zmniejszenie o 80% liczby zmian wykazujących wzmocnienie kontrastowe[5].
Mechanizm działania
Teryflunomid jest środkiem immunomodulującym, który w sposób wybiórczy i odwracalny hamuje aktywność enzymu mitochondrialnego – dehydrogenazy dihydroorotanowej, wymaganego do syntezy pirymidyny de novo. W rezultacie teryflunomid zmniejsza proliferację podzielonych komórek, które do ekspansji potrzebują syntezy pirymidyny de novo[7]. Dokładny mechanizm terapeutycznego działania teryflunomidu w leczeniu stwardnienia rozsianego nie jest do końca wyjaśniony, ale może on obejmować redukcję liczby limfocytów. Mediana czasu do osiągnięcia maksymalnego stężenia w osoczu wynosi 1–4 h po wielokrotnym doustnym podaniu teryflunomidu, przy wysokiej biodostępności (około 100%). Osiągnięcie stężenia stanu stacjonarnego jest procesem powolnym (tj. osiągnięcie 95% stężenia w stanie stacjonarnym następuje po około 100 dniach, a szacowany współczynnik kumulacji AUC jest ok. 34-krotny). Teryflunomid w znacznym stopniu wiąże się z białkami osocza (>99%), prawdopodobnie z albuminą, i podlega dystrybucji głównie w osoczu. Metabolizowany jest w stopniu umiarkowanym i jest jedynym składnikiem wykrywanym w osoczu. Głównym szlakiem metabolizmu teryflunomidu jest hydroliza, a utlenianie stanowi szlak drugorzędny. Wydzielany jest do przewodu pokarmowego głównie z żółcią jako produkt leczniczy w postaci niezmienionej i najprawdopodobniej przez sekrecję bezpośrednią[8].
W przypadku teryflunomidu można w określonych w charakterystyce produktu przypadkach przeprowadzić procedurę przyspieszonej eliminacji. Eliminacja teryflunomidu z krążenia może być przyspieszona po podaniu cholestyraminy lub węgla aktywowanego, przypuszczalnie wskutek przerwania procesów wchłaniania zwrotnego na poziomie jelit[8].
Przypisy
- ↑ a b Teriflunomide, [w:] DrugBank [online], University of Alberta, DB08880 (ang.).
- ↑ Teriflunomide (nr SML0936) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2017-05-26]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ D. Magne i inni, The active metabolite of leflunomide, A77 1726, increases proliferation of human synovial fibroblasts in presence of IL-1β and TNF-α, „Inflammation Research”, 55 (11), 2006, s. 469–475, DOI: 10.1007/s00011-006-5196-x, PMID: 17122964.
- ↑ A. Doshi, J. Chataway, Multiple sclerosis, a treatable disease, „Clinical Medicine”, 16 (Suppl 6), 2016, s53–s59, DOI: 10.7861/clinmedicine.16-6-s53, PMID: 27956442.
- ↑ a b Jacek Losy i inni, Leczenie stwardnienia rozsianego. Zalecenia Polskiego Towarzystwa Neurologicznego, „Polski Przegląd Neurologiczny”, 12 (2), 2016, s. 80–95.
- ↑ Aubagio, Centrum Informacji o Leku [dostęp 2017-02-07] [zarchiwizowane z adresu 2017-02-08].
- ↑ Jarosław Filipek, Nowe rejestracje UE – sierpień 2013, Aptekarz Polski, 26 września 2013 [dostęp 2017-02-07].
- ↑ a b Charakterystyka produktu leczniczego – Aubagio [dostęp 2017-02-07].
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.