Tetrachlorometan
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | CCl4 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 153,82 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | bezbarwna, przezroczysta ciecz[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | chlorometan, dichlorometan, trichlorometan, tetrafluorometan, tetrabromometan, tetrajodometan, tetrachloroeten | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||
Tetrachlorometan, czterochlorek węgla – organiczny związek chemiczny z grupy halogenoalkanów, w pełni chlorowana pochodna metanu. Dawniej powszechnie stosowany jako tani rozpuszczalnik, szczególnie często używany przy ekstrakcji tłuszczów i innych związków organicznych z roślin, a także jako dodatek do środków czystości, rozpuszczalnik do farb i klejów (m.in. butaprenu). Do lat 80. XX wieku był stosowany jako środek gaśniczy w gaśnicach tetrowych. Stosowany także jako rozpuszczalnik w niektórych syntezach chemicznych.
Odkrycie
Został odkryty w 1840 roku przez francuskiego chemika Henriego Victora Regnault.
Zastosowanie
Obecnie użycie tetrachlorometanu jest zredukowane do minimum, a jego obrót w handlu jest ściśle reglamentowany. Wynika to z faktu, że uważa się go za niebezpieczny dla środowiska naturalnego. Opary działają toksycznie przez drogi oddechowe, w cieczy drażniąco działa na oczy, w kontakcie ze skórą i po połknięciu. Jest związkiem hepatotoksycznym – powoduje uszkodzenie komórek wątroby i w konsekwencji doprowadza do ostrego uszkodzenia wątroby. Stwarza poważne zagrożenie dla zdrowia w następstwie długotrwałego narażenia. Istnieją ograniczone dowody działania rakotwórczego. Działa szkodliwie na organizmy wodne. Może powodować długo utrzymujące się niekorzystne zmiany w środowisku wodnym. Podejrzewa się, że stwarza zagrożenie dla warstwy ozonowej (tzw. dziura ozonowa).
Stosowany jest nadal jako rozpuszczalnik w analizie chemicznej i w syntezie w skali laboratoryjnej. Ze względu na swoje właściwości, tetrachlorometan wraz z heksanem jest używany do wyznaczania gęstości kryształów nierozpuszczalnych w silnie niepolarnych rozpuszczalnikach.
Właściwości
Właściwości fizyczne
W temperaturze pokojowej jest to bezbarwna ciecz o słodkawym zapachu. Niepalny, słabo rozpuszczalny w wodzie, mieszalny z rozpuszczalnikami organicznymi (etanolem, benzenem, benzyną). Rozpuszcza oleje, tłuszcze, żywice i inne substancje lipofilowe. Jest to rozpuszczalnik wysoce niepolarny o dużej gęstości (1,59 g/cm³). Pod wpływem wyładowań elektrycznych lub wysokiej temperatury, w obecności tlenu powstaje z niego fosgen. Opary są kilkakrotnie cięższe od powietrza, co wykorzystywano w gaśnicach do dezaktywacji wolnych rodników w płomieniu i izolacji źródła ognia od dostępu powietrza.
Właściwości chemiczne
Czterochlorek węgla wykazuje lekkie własności utleniające. Np. w reakcji z diestrami H-fosfonianowymi przekształca je w chlorofosforany:
- (RO)
2P(H)O + CCl
4 → (RO)
2P(Cl)O + CHCl
3
Powyższy proces stanowi podstawę metody Athertona-Todda otrzymywania amidofosforanów i triestrów fosforanowych[5]:
- (RO)
2P(H)O + CCl
4 + RNH
2 → [(RO)
2P(Cl)O] → (RO)
2P(NHR)O- (RO)
2P(H)O + CCl
4 + R
3N + R1
OH → [(RO)
2P(Cl)O] → (R1
O)(RO)
2PO - (RO)
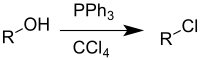
Czterochlorek węgla jest stosowany do syntezy chlorków alkilowych z alkoholi w tzw. reakcji Appela zachodzącej w obecności trifenylofosfiny. W przypadku chiralnych alkoholi drugorzędowych powstający chlorek ma przeciwną konfigurację absolutną asymetrycznego atomu węgla. Chiralne alkohole trzeciorzędowe ulegają reakcji z CCl
4 zgodnie z mechanizmem substytucji SN1, dlatego otrzymuje się produkt jako mieszaninę racemiczną.
Otrzymywanie
Produkcja czterochlorku węgla polega na fotochemicznym, wyczerpującym chlorowaniu metanu w fazie gazowej w wysokiej temperaturze (ok. 400 °C):
- CH
4 + 4Cl
2 → CCl
4 + 4HCl
Można go też otrzymać przez działanie chlorem na disiarczek węgla w obecności katalizatorów.
Zobacz też
- lista czynników chłodniczych
Przypisy
- ↑ a b c d e Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- ↑ a b c d e Carbon tetrachloride (nr 289116) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2017-01-07]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b Tetrachlorometan (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2017-01-07].
- ↑ Tetrachlorometan (nr 289116) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Stanów Zjednoczonych. [dostęp 2017-01-07]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ F.R. Atherton. Some Aspects of the Organic Chemistry of Derivatives of Phosphorus Oxyacids. „Quarterly Review of the Chemical Society”. 3 (2), s. 146–159, 1949. DOI: 10.1039/QR9490300146.
Media użyte na tej stronie
Symbol of pollutants to the environment, according to the directive 67/548/EWG of 'European Chemicals Bureau (European Chemicals Agency).
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Molecular Structure of Carbon tetrachloride, also called Tetrachloromethane
The Appel reaction is an organic reaction that converts an alcohol into an alkyl chloride using triphenylphosphine and carbon tetrachloride. The use of carbon tetrabromide or bromine as a halide source will yield alkyl bromides, whereas using methyl iodide or iodine gives alkyl iodides. The reaction is credited to and named after Rolf Appel, it had however been described earlier. The use of this reaction is becoming less common, due to carbon tetrachloride being restricted under the Montreal protocol.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances