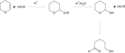Tetrahydropiran
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C5H10O | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 86,13 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | bezbarwna ciecz o ostrym zapachu[1] | ||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||
Tetrahydropiran, THP – heterocykliczny, organiczny związek chemiczny z grupy eterów, którego sześcioczłonowy pierścień zbudowany jest z pięciu atomów węgla i jednego atomu tlenu.
Pierścień tetrahydropiranu stanowi rdzeń piranoz – rodziny węglowodanów. Najbardziej powszechną piranozą jest glukoza.
Synteza
Klasyczną metodą syntezy organicznej tetrahydropiranu jest uwodornienie na niklu Raneya dihydropiranu[9].
Reakcje chemiczne
Tetrahydropiran jak większość eterów jest słabo reaktywny i dlatego może być stosowany jako rozpuszczalnik organiczny w reakcjach. W syntezie organicznej grupa 2-tetrahydropiranylowa jest stosowana jako grupa blokująca dla alkoholi[10][11].
 Pierścień THP jako acetalowa grupa ochronna. Pierwszy etap – wprowadzenie THP do alkoholu ROH poprzez reakcję z dihydropiranem. Etap drugi: hydroliza kwasowa i uwolnienie alkoholu; powstały cykliczny hemiacetal jest nietrwały i hydrolizuje dalej do hydroksykwasu karboksylowego (5-hydroksywalerianowego)
Pierścień THP jako acetalowa grupa ochronna. Pierwszy etap – wprowadzenie THP do alkoholu ROH poprzez reakcję z dihydropiranem. Etap drugi: hydroliza kwasowa i uwolnienie alkoholu; powstały cykliczny hemiacetal jest nietrwały i hydrolizuje dalej do hydroksykwasu karboksylowego (5-hydroksywalerianowego)
Przypisy
- ↑ Tetrahydropyran, [w:] PubChem [online], United States National Library of Medicine, CID: 8894 (ang.).
- ↑ a b c d e Haynes 2014 ↓, s. 3-502.
- ↑ Haynes 2014 ↓, s. 5-197.
- ↑ a b Haynes 2014 ↓, s. 5-186.
- ↑ a b c Haynes 2014 ↓, s. 6-73.
- ↑ a b Haynes 2014 ↓, s. 15-21.
- ↑ Haynes 2014 ↓, s. 9-59.
- ↑ Tetrahydropiran (nr 293105) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Stanów Zjednoczonych. [dostęp 2015-11-28]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ D.W. Andrus, John R. Johnson, Tetrahydropyran, „Organic Syntheses”, 23, 1943, s. 90, DOI: 10.15227/orgsyn.023.0090 (ang.).
- ↑ R.A. Earl, L.B. Townsend, Methyl 4-hydroxy-2-butynoate, „Organic Syntheses”, 60, 1981, s. 81, DOI: 10.15227/orgsyn.060.0081 (ang.).
- ↑ Arthur F. Kluge, Diethyl [(2-tetrahydropyranyloxy)methyl]phosphonate, „Organic Syntheses”, 64, 1986, s. 80, DOI: 10.15227/orgsyn.064.0080 (ang.).
Bibliografia
- CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 95, Boca Raton: CRC Press, 2014, ISBN 978-1-4822-0867-2 (ang.).
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
The hazard symbol for flammable/highly flammable substances according to directive 67/548/EWG by the European Chemicals Bureau.
Chemical structure of tetrahydropyran. Left: planar view, right: steric representation of the chair conformation