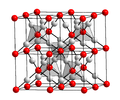
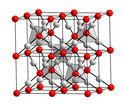
Tlenek miedzi(I)
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | Cu2O | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 143,08 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | czerwonobrązowe kryształy[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Inne aniony | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Inne kationy | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||
Tlenek miedzi(I), Cu2O – nieorganiczny związek chemiczny z grupy tlenków, w którym miedź występuje na I stopniu utlenienia. W przyrodzie występuje jako minerał o nazwie kupryt (o mocno czerwonym zabarwieniu) i przez wieki był jednym z głównych źródeł miedzi. Tlenek miedzi(I) stosowany jest do barwienia szkła.
Otrzymywanie
Metody otrzymywania[5]:
- ogrzewanie metalicznej miedzi z tlenkiem miedzi(II):
- CuO + Cu → Cu
2O
- piroliza tlenku miedzi(II) (temp. >800 °C):
- 4CuO → 2Cu
2O + O
2↑
- piroliza węglanu amonu miedzi(I):
- 2CuNH
4CO
3 → Cu
2O + 2CO
2↑ + 2NH
3↑ + H
2O↑
- redukcja soli Cu2+
za pomocą N
2H
4 - redukcja Cu(OH)
2 np. za pomocą SO
2 lub glukozy (por. próba Trommera i próba Fehlinga) - reakcja chlorku miedzi(I) z alkaliami, np.:
- 2CuCl + 2NaOH → Cu
2O↓ + 2NaCl + H
2O
- elektroliza roztworu NaCl z użyciem elektrod miedzianych.
Właściwości
Tworzy czerwonawobrązowe sześcienne kryształy[5]. Nie rozpuszcza się w wodzie[5], natomiast roztwarza się w wodzie amoniakalnej[6]:
- Cu
2O + 4NH
3 + H
2O → 2[Cu(NH
3)
2]+
+ 2OH−
a także w stężonym kwasie solnym[6]:
- Cu
2O + 4HCl + H
2O → 2[CuCl
2]−
+ 2H
3O+
Utlenia się do tlenku miedzi(II), natomiast ogrzewany w atmosferze wodoru redukuje się do wolnej miedzi[5].
Przypisy
- ↑ a b c d e David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 4-61, ISBN 978-1-4200-9084-0 (ang.).
- ↑ a b Tlenek miedzi(I) (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-04-10].
- ↑ a b c Tlenek miedzi(I) (nr 566284) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2012-07-16]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Tlenek miedzi(I) (nr 566284) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Stanów Zjednoczonych. [dostęp 2012-07-16]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b c d Copper(I) oxide, [w:] Pradyot Patnaik, Handbook of Inorganic Chemicals, London: McGraw-Hill, 2003, s. 271–273, ISBN 0-07-049439-8 (ang.).
- ↑ a b Tlenki miedziowców, [w:] Adam Bielański, Podstawy chemii nieorganicznej, wyd. 5, Warszawa: PWN, 2002, s. 965–966, ISBN 83-01-13654-5.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Symbol of pollutants to the environment, according to the directive 67/548/EWG of 'European Chemicals Bureau (European Chemicals Agency).
Autor: Orci, Licencja: CC BY-SA 3.0
crystal structure of en:copper(I) oxide
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances