Tlenek osmu(VIII)
| |||||||||||||||||||||||||||
 Próbka OsO 4 w ampułce | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||
| Wzór sumaryczny | OsO | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 254,23 g/mol | ||||||||||||||||||||||||||
| Wygląd | |||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||
| Podobne związki | tlenek rutenu(VIII) | ||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||
Tlenek osmu(VIII), OsO
4 – nieorganiczny związek chemiczny z grupy tlenków, w którym osm występuje na VIII stopniu utlenienia. Jest półproduktem w otrzymywaniu osmu z rud, a w chemii organicznej stosowany jest jako utleniacz w dihydroksylacji olefin.
Otrzymywanie
Otrzymać go można kilkoma metodami:
- utlenianie wodnych roztworów związków osmu, np. osmianu sodu, Na
2OsO
4, za pomocą stężonego kwasu azotowego, a następnie wydzielenie lotnego OsO
4 przez destylację (metoda przemysłowa)[3]; - utlenianie chlorku osmu(IV), OsCl
4, za pomocą roztworu podchlorynu sodu[3]; - ogrzewanie rozdrobnionego osmu metalicznego w tlenie w temperaturze 300–400 °C[3]. Metoda ta jest najbardziej użyteczna w warunkach laboratoryjnych. Powstający gazowy OsO
4 ulega kondensacji w schłodzonej części aparatury, tworząc białe, błyszczące kryształy[1].
Właściwości
Tlenek osmu(VIII) jest białym lub żółtawym krystalicznym ciałem stałym[1] o niskiej temperaturze topnienia (40,6 °C) i wrzenia (129,7 °C). Rozpuszcza się w wodzie (bez rozkładu[1]) i w większości rozpuszczalników organicznych[3]. Można przeprowadzać go w stan gazowy w warunkach destylacji z parą wodną[1]. Jest silnie trujący w każdej formie po dostaniu się do organizmu[3]. Ma nieprzyjemny[2] zapach przypominający chlor[4]. Jest odporny na działanie światła i może być przechowywany bez ograniczeń w naczyniach z bezbarwnego szkła[1]. Jest też stabilny termicznie, dopiero w temperaturze powyżej 800 °C ulega rozkładowi do OsO
3; natomiast ogrzewany z metalicznym osmem daje OsO
2[3].
Ulega redukcji wodorem, na zimno do OsO
2, na gorąco do wolnego osmu[5].
Reaguje ze stężonym kwasem solnym z wydzieleniem chloru[1]. Z wodorotlenkami potasowców daje sole o wzorze Me
2OsO
4(OH)
2 oraz – w przypadku RbOH i CsOH – MeOsO
4(OH) i in. Reaguje też z fluorkami, tworząc jony [OsO
4F
2]2−
, a z amoniakiem wobec alkaliów daje anion [N≡OsO
3]−
. Z licznymi związkami organicznymi tworzy rozmaite związki kompleksowe[3].
Zastosowanie
Otrzymywanie osmu
Tlenek osmu(VIII) jest półproduktem w otrzymywaniu osmu z minerałów zawierających inne platynowce, zwłaszcza do oddzielania soli osmu od związków rutenu. Wykorzystuje się tu fakt, że w wyniku utleniania kwasem azotowym roztworów OsVI
powstaje lotny OsO
4, podczas gdy jony Ru^{VI} dają kompleksy z kwasem azotowym. Po oddestylowaniu OsO
4 rozpuszcza się go w wodnym roztworze NaOH z dodatkiem etanolu i dodaje chlorek amonu. Prowadzi to wytrącenia się kompleksu OsO
2(NH
3)
4Cl
2, który redukuje się wodorem do metalicznego osmu[3].
Dihydroksylacja
W chemii organicznej stosowany jest do dihydroksylacji wiązania podwójnego C=C z wytworzeniem dioli wicynalnych, C(OH)−C(OH)[3]:
Pierwszym etapem reakcji jest cykloaddycja [3+2] prowadząca do cyklicznego diestru osmianowego(VI)[a], który ulega następnie hydrolizie, np. za pomocą roztworu Na
2SO
3 do diolu[7]. Zamiast OsO
4 w reakcji tej można stosować nadmanganian potasu, KMnO
4, który jest tańszy i bezpieczniejszy, jednak wydajności produktów są niższe. Mechanizm procesu jest analogiczny[8].
Reakcję tę prowadzi się zwykle wobec dodatkowych utleniaczy, np. K
3Fe(CN)
6, dzięki czemu drogi i trujący OsO
4 jest regenerowany w mieszaninie reakcyjnej i można używać go w ilościach katalitycznych[9][10]. W obecności chiralnych ligandów reakcja ta przebiega stereoselektywnie, umożliwiając otrzymywanie dioli chiralnych o określonej konfiguracji[11]. Reakcja ta znana jest jako asymetryczna dihydroksylacja Sharplessa[12]:
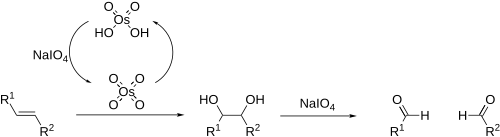
Jeżeli dihydroksylację prowadzi się w obecności nadjodanu sodu, pełni on rolę utleniacza odtwarzającego OsO
4, a jednocześnie powoduje rozerwanie wiązania C(OH)−C(OH). W efekcie olefina przekształcana jest w dwie cząsteczki aldehydów (utlenianie Lemieux-Johnsona)[13][14]:
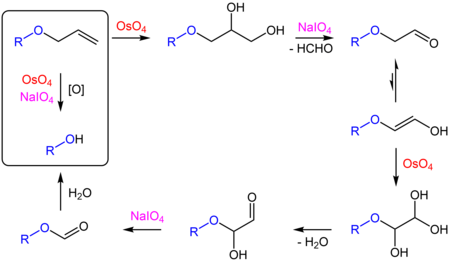
Reakcję tę wykorzystuje się do usuwania allilowych grup ochronnych alkoholi (RO−CH
2−CH=CH
2 → ROH) i amin (RNH−CH
2−CH=CH
2 → RNH
2). Mechanizm reakcji jest następujący[15]:
Mikroskopia
Tlenek osmu(VIII) jest też stosowany w mikroskopii do utrwalania i barwienia preparatów biologicznych[3].
Uwagi
- ↑ Inny możliwy mechanizm powstawania diestru osmianowego to cykloaddycja [2+2], w wyniku której powstaje tylko jedno wiązanie estrowe C−O−Os, natomiast drugi atom węgla łączy się bezpośrednio z atomem osmu wiązaniem C−Os. Czteroczłonowy produkt cykliczny ulega następnie przegrupowaniu do pięcioczłonowego diestru[6].
Przypisy
- ↑ a b c d e f g H.L. Grube, Osmium (VIII) Oxide, [w:] Georg Brauer (red.), Handbook of Preparative Inorganic Chemistry, t. 2, New York–London: Academic Press, 1965, s. 1603–1604.
- ↑ a b Tetratlenek osmu (nr O5500) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2019-05-28]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b c d e f g h i j k l m n o p q r Osmium tetroxide, [w:] Pradyot Patnaik, Handbook of Inorganic Chemicals, London: McGraw-Hill, 2003, s. 671–674, ISBN 0-07-049439-8 (ang.).
- ↑ Osmium tetroxide, [w:] PubChem [online], United States National Library of Medicine, CID: 30318 (ang.).
- ↑ H.L. Grube, Osmium (IV) Oxide, [w:] Georg Brauer (red.), Handbook of Preparative Inorganic Chemistry, t. 2, New York–London: Academic Press, 1965, s. 1603.
- ↑ The cis-vic Dihydroxylation of Alkenes: No Oxidative Cleavage, but an Important Prelude, [w:] Reinhard Bruckner, Organic Mechanisms. Reactions, Stereochemistry and Synthesis, Berlin–Heidelberg: Springer, 2010, s. 562–563, DOI: 10.1007/978-3-642-03651-4, ISBN 978-3-642-03650-7 (ang.).
- ↑ Joseph M. Hornback, Organic Chemistry, wyd. 2, Thomson Brooks/Cole, 2006, s. 439, ISBN 0-534-38951-1 (ang.).
- ↑ Kenneth A. Savin, Writing Reaction Mechanisms in Organic Chemistry, wyd. 3, Elsevier/Academic Press, 2015, s. 366–367, DOI: 10.1016/C2012-0-07415-7, ISBN 978-0-12-411475-3 (ang.).
- ↑ Makoto Minato, Keiji Yamamoto, Jiro Tsuji, Osmium tetraoxide catalyzed vicinal hydroxylation of higher olefins by using hexacyanoferrate(III) ion as a cooxidant, „Journal of Organic Chemistry”, 55 (2), 1990, s. 766–768, DOI: 10.1021/jo00289a066 (ang.).
- ↑ Javier Gonzalez, Christine Aurigemma, Larry Truesdale, Synthesis of (+)-(1S,2R)- and (−)-(1R,2S)-trans-2-phenylcyclohexanol via Sharpless asymmetric dihydroxylation (AD), „Organic Syntheses”, 79, 2002, s. 93, DOI: 10.15227/orgsyn.079.0093.
- ↑ Hartmuth C. Kolb, Michael S. Van Nieuwenhze, K. Barry Sharpless, Catalytic Asymmetric Dihydroxylation, „Chemical Reviews”, 94 (8), 1994, s. 2483–2547, DOI: 10.1021/cr00032a009 (ang.).
- ↑ Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro, Name Reactions and Reagents in Organic Synthesis, Hoboken: John Wiley & Sons, 2005, DOI: 10.1002/9780471739876, ISBN 978-0-471-73987-6 (ang.).
- ↑ R. Pappo i inni, Osmium Tetroxide-Catalyzed Periodate Oxidation of Olefinic Bonds, „Journal of Organic Chemistry”, 21 (4), 1956, s. 478–479, DOI: 10.1021/jo01110a606 (ang.).
- ↑ Oxidative Cleavage of Alkenes, [w:] Reinhard Bruckner, Organic Mechanisms. Reactions, Stereochemistry and Synthesis, Berlin–Heidelberg: Springer, 2010, s. 566–567, DOI: 10.1007/978-3-642-03651-4, ISBN 978-3-642-03650-7 (ang.).
- ↑ Pavel I. Kitov, David R. Bundle, Mild Oxidative One-Pot Allyl Group Cleavage, „Organic Letters”, 3 (18), 2001, s. 2835–2838, DOI: 10.1021/ol016278t (ang.).
Media użyte na tej stronie
Autor: W. Oelen, Licencja: CC BY-SA 3.0
100 mg of osmium tetroxide in a glass ampoule.
Autor: RicHard-59, Licencja: CC BY-SA 4.0
Structural formula of the osmium tetroxide molecule, OsO4.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Autor: Project Osprey, Licencja: CC BY-SA 3.0
Lemieux–Johnson oxidation. Converting an alkene to a diol then two aldehydes using catalytic osmium tetroxide and sodium periodate
Autor: Project Osprey, Licencja: CC BY-SA 3.0
Dihydroxylation of alkenes with OsO4
Description: Reaction mechanims of the Sharpless dihydroxylation.
- Author, date of creation: selfmade by ~K, 20 August 2006.
- Source: -
- Copyright: Public domain. (PD)
- Comments: high-resolution b/w PNG; ChemDraw / The GIMP.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Oksydatywne usuwanie grupy allilowej