Tlenki węgla
Tlenki węgla – związki chemiczne składające się z węgla i tlenu[a].
Najprostsze i spotykane powszechnie tlenki węgla to tlenek węgla (CO) i dwutlenek węgla (CO2). Poza nimi znanych jest wiele innych trwałych lub metatrwałych tlenków węgla, np. tzw. podtlenek węgla (ditlenek triwęgla, O=C=C=C=O) odkryty przez Brodiego w 1873 roku[4] i bezwodnik melitowy (C12O9) opisany przez Meyera i Steinera w 1913 roku[5][6][7]. W roku 1859 Brodie opisał też tzw. tlenek grafitu[8], który jednak według współczesnej wiedzy zawiera także liczne grupy hydroksylowe[9] (z tlenku grafitu można uzyskać tlenek grafenu o jednowarstwowej strukturze analogicznej do grafenu[9]).
 | |||||||
| CO Tlenek węgla | CO2 Dwutlenek węgla | C3O2 Podtlenek węgla | C12O9 Bezwodnik melitowy |
Przez wiele dziesiątków lat te związki były powszechnie uważane za jedyne trwałe tlenki węgla. Jednak od lat 60. XX wieku utworzono nowe związki, z których część była trwała w temperaturze pokojowej. Niektóre były metatrwałe lub trwałe tylko w bardzo niskich temperaturach i rozkładały się na prostsze po ogrzaniu. Wiele było nietrwałych, które mogły być obserwowane jako etapy przejściowe reakcji chemicznych, lub tak reaktywnych, że mogły istnieć tylko w fazie gazowej lub w warunkach izolacji matrycowej. Ważne przykłady tych ostatnich to monotlenek diwęgla (rodnik :C=C=O), tritlenek węgla (CO3)[10] i 1,2-dioksoetandion (C2O4)[11][12]. Niektóre z tych reaktywnych tlenków węgla zostały wykryte w obłokach molekularnych w przestrzeni międzygwiazdowej dzięki spektroskopii rotacyjnej[13].
Wiele hipotetycznych tlenków węgla badano metodami teoretycznymi, np. bezwodnik szczawiowy (C2O3 albo O=(C2O)=O), etylenodion (C2O2 albo O=C=C=O)[14] i inne liniowe lub pierścieniowe polimery tlenku węgla (−C(=O)−)n (poliketony)[15] oraz liniowe i pierścieniowe polimery dwutlenku węgla −(O−C(=O)−)n, jak dimer 1,3-dioksetanodion (C2O4)[16] i trimer 1,3,5-trioksanotrion (C3O6)[16][17].
 |  | 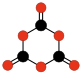 | |||||||
| C2O3 Bezwodnik szczawiowy | C2O4 1,2-Dioksetano- dion | C2O4 1,3-Dioksetano- dion | C3O6 1,3,5-Trioksano- trion | C2O2 Etyleno- dion |
Liczba znanych tlenków węgla wciąż rośnie. Istnienie tlenku grafitu i innych trwałych polimerycznych tlenków węgla o nieograniczonej strukturze molekularnej[18][8] sugeruje, że wiele innych pozostało do odkrycia.
Liniowe dwutlenki węgla
Liniowe dwutlenki węgla tworzą szereg homologiczny o wzorze ogólnym CnO2 lub O=(C=)nO. Zbudowane są z prostego łańcucha atomów węgla połączonych skumulowananymi wiązaniami podwójnymi i zakończonego na obu końcach atomami tlenu. Pierwsi przedstawiciele szeregu to
- CO2 albo O=C=O, dwutlenek węgla.
- C2O2 albo O=C=C=O, skrajnie nietrwały etylenodion[14].
- C3O2 albo O=C=C=C=O, metatrwały podtlenek węgla albo ditlenek triwęgla.
- C4O2 albo O=C=C=C=C=O, ditlenek tetrawęgla albo 1,2,3-butatrien-1,4-dion[19]
- C5O2 albo O=C=C=C=C=C=O, ditlenek pentawęgla[20], trwały w roztworze w temperaturze pokojowej, a w postaci czystej poniżej −90 °C[21].
Wyższe człony tego szeregu odkryto w ilościach śladowych w gazach pod niskim ciśnieniem lub eksperymentach z macierzami kriogenicznymi, zwłaszcza dla n = 7[21] oraz n = 17, 19 i 21[22].
Liniowe monotlenki węgla
Inną grupą tlenków węgla są liniowe tlenki węgla CnO. Pierwszy członek, zwykły tlenek węgla CO, wydaje się być jedynym trwałym w stanie czystym w temperaturze pokojowej. Fotoliza liniowych dwutlenków węgla w macierzy kriogenicznej prowadzi do utraty CO i powstania wykrywalnych ilości jednotlenków o parzystej liczbie atomów węgla takich jak C2O, C4O[23] i C6O[21]. Człony do n = 9 uzyskano też przy wyładowaniach elektrycznych w gazowym C3O2 wymieszanym z argonem[24]. Pierwsze trzy człony szeregu obserwowano w przestrzeni międzygwiezdnej[24].
Uważa się, że kiedy n jest parzyste, cząsteczki są w stanie trypletowym (jak kumuleny), z atomami połączonymi wiązaniami podwójnymi i niezapełnionym orbitalem pierwszego węgla – jak w :C=C=O, :C=C=C=C=O i ogólnie :(C=)n=O. Kiedy n jest nieparzyste, struktura trypletowa jest prawdopodobnie w rezonansie z singletową (jak w acetylenie) polarną strukturą z ładunkiem ujemnym na końcu węglowym i dodatnim na atomie tlenu, jak w −+C≡C−C≡O, −+C≡C−C≡C−C≡O i ogólnie −(C≡C−)n/2C≡O+[24]. Tlenku węgla też dotyczy ta struktura: za dominującą formę jest uważana −+C≡O[25].
Cykliczne radialenowe tlenki węgla
Inną interesującą rodziną tlenków węgla są cykliczne radialenowe tlenki CnOn albo (CO)n[26]. Mogą być uważane za pierścieniowe polimery tlenku węgla lub n-krotne ketony n-węglowych cykloalkanów. Pierwsze dwa człony to sam tlenek węgla (CO) i skrajnie nietrwały etylenodion C2O2 albo O=C=C=O[14]. Teoretyczne analizy sugerują, że następne cztery człony szeregu – C3O3, C4O4, C5O5 i C6O6 – mogą być trwałe, ale dotąd udało się je wytworzyć tylko w śladowych ilościach[27].
 |  |  |  | ||||
| (CO)3 Cyklopropano- trion | (CO)4 Cyklobutano- tetron | (CO)5 Cyklopentano- penton | (CO)6 Cykloheksano- hekson |
Z drugiej strony aniony tych związków są dość stabilne, a niektóre z nich są znane od XIX wieku[26]. Są to:
- C2O2−2, anion acetylenodiolowy (Weiss i Büchner, 1963)[28]
- C3O2−3, anion kwasu deltowego (dihydroksycyklopropanonu; Eggerding i West, 1976)[29][30],
- C4O2−4, anion kwasu kwadratowego (1,2-dihydroksycyklobutano-3,4-dionu; Cohen i inni, 1959)[31]
- C5O2−5, anion kwasu krokonowego (1,2-dihydroksycyklopentano-3,4,5-trionu; Gmelin, 1825)[32]
- C6O2−6, anion kwasu rodyzonowego (1,2-dihydroksycykloheksano-3,4,5,6-tetronu; Heller, 1837)[33][34].
Tlenek C6O6 tworzy też trwałe aniony tetrahydroksybenzochinonu (C6O4−6) i heksahydroksybenzenu (C6O6−6)[35]. Aromatyczność tych anionów była badana metodami teoretycznymi[36][37].
Nowe tlenki
Wiele nowych trwałych i metatrwałych tlenków otrzymano począwszy od lat 60. XX wieku. Należą do nich:
- C12O12 albo C6(C2O4)3, tris(szczawian) heksahydroksybenzenu (1967); trwały jako solwat tetrahydrofuranu[38].
- C10O10 albo C6O2(C2O4)2, bis(szczawian) tetrahydroksy-p-benzochinonu (1968); trwały jako solwat tetrahydrofuranu[39]
- C8O8 albo C6O2(CO3)2, bis(węglan) tetrahydroksy-p-benzochinonu (1984); rozkłada się w temperaturze około 45–53 °C.[40]
- C9O9 albo C6(CO3)3, tris(węglan) heksahydroksybenzenu (1984); rozkłada się w temperaturze około 45–53 °C.[40]
- C24O6 i C32O8, odpowiednio pierścieniowy trimer i tetramer podwójnego rodnika, 3,4-dialkinylo-3-cyklobuteno-1,2-dionu −C≡C−(C4O2)−C≡C− (1990)[41]
- C4O6, dioksanotetron albo dimer bezwodnika szczawiowego (1998); trwały w Et2O w temperaturze −30 °C, rozkłada się w temperaturze 0 °C.[42]
- C12O6, heksaoksotricyklobutabenzen (2006)[43][44]
Polimeryczne tlenki węgla
Podtlenek węgla (O=C=C=C=O) ulega spontanicznej polimeryzacji do ciała stałego o żółtym lub brązowym zabarwieniu[45], zarówno z fazy gazowej (tworzy barwne filmy na ściankach naczynia), jak i z roztworu (ciemnobrązowy precypitat)[18]. Badania spektroskopowe, rentgenograficzne i analiza rozkładu termicznego sugerują, że polimer zbudowany jest ze skumulowanych sześcioczłonowych pierścieni α-pironu (walerolaktonu). Pomiary fizyczne wskazują, że średnia liczba merów w cząsteczce wynosi około 5–6, zależnie od temperatury tworzenia[18][46]. W substancji stwierdzono występowanie szeregu oligomerów[18]:
 |  |  |  | ||||||
| Oligomery C3O2 o 3–6 jednostkach. | |||||||||
Innym polimerem węglowotlenowym, o stosunku C:O wynoszącym 5:1 lub więcej, jest klasyczny tlenek grafitu[8] i jego jednowarstwowa postać tlenek grafenu.
Uwagi
- ↑ W literaturze anglojęzycznej funkcjonuje termin oxocarbons (analogicznie w niektórych innych językach) oznaczający wg IUPAC związki zbudowane wyłącznie z węgla i tlenu[1]. Został on wprowadzony w roku 1963 przez Roberta Westa(ang.) i Davida L. Powella[2][3]. West definiuję tę nazwę nieco inaczej niż IUPAC, jako związki, w których wszystkie lub prawie wszystkie atomy węgla tworzą układy karbonylowe (C=O) lub enolowe (C=C−OH), lub ich formy hydratowane lub deprotonowane[2]. W polskiej nomenklaturze chemicznej analogiczny termin nie jest stosowany.
Przypisy
- ↑ Oxocarbons, [w:] A.D. McNaught, A. Wilkinson, Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.O04375, ISBN 0-9678550-9-8 (ang.).
- ↑ a b Robert C. West: Oxocarbons. Elsevier, 2012, s. 1. ISBN 978-0-323-15916-6.
- ↑ Robert West, David L. Powell. New Aromatic Anions. III. Molecular Orbital Calculations on Oxygenated Anions. „Journal of the American Chemical Society”. 85 (17), s. 2577-2579, 1963. DOI: 10.1021/ja00900a010.
- ↑
 B.C. Brodie. Note on the Synthesis of Marsh-Gas and Formic Acid, and on the Electric Decomposition of Carbonic Oxide. „Proceedings of the Royal Society of London”, s. 245–247, 1873. DOI: 10.1098/rspl.1872.0052.
B.C. Brodie. Note on the Synthesis of Marsh-Gas and Formic Acid, and on the Electric Decomposition of Carbonic Oxide. „Proceedings of the Royal Society of London”, s. 245–247, 1873. DOI: 10.1098/rspl.1872.0052. - ↑
 J. Liebig, F. Wöhler. Ueber die Zusammensetzung der Honigsteinsäure. „Poggendorfs Annalen der Physik und Chemie”. 94 (2), s. 161–164, 1830. [dostęp 2016-09-04].
J. Liebig, F. Wöhler. Ueber die Zusammensetzung der Honigsteinsäure. „Poggendorfs Annalen der Physik und Chemie”. 94 (2), s. 161–164, 1830. [dostęp 2016-09-04]. - ↑ H. Meyer, K. Steiner. Über ein neues Kohlenoxyd C12O9. „Berichte der Deutschen Chemischen Gesellschaft”, s. 813–815, 1913. DOI: 10.1002/cber.191304601105.
- ↑
 Bugge. Chemie: En neues Kohenoxyd. Review of Meyer and Steiner's discovery of C12O9. „Naturwissenschaftliche Wochenschrift”. 13/29 (12), s. 188, 1914. [dostęp 2016-09-04].Sprawdź autora:1.
Bugge. Chemie: En neues Kohenoxyd. Review of Meyer and Steiner's discovery of C12O9. „Naturwissenschaftliche Wochenschrift”. 13/29 (12), s. 188, 1914. [dostęp 2016-09-04].Sprawdź autora:1. - ↑ a b c William S. Hummers, Richard E. Offeman. Preparation of Graphitic Oxide. „J. Am. Chem. Soc.”. 80 (6), s. 1339–1339, 1958. DOI: 10.1021/ja01539a017.
- ↑ a b Daniel R. Dreyer, Sungjin Park, Christopher W. Bielawski, Rodney S. Ruoff. The chemistry of graphene oxide. „Chemical Society Reviews”. 39 (1), s. 228–240, 2010. DOI: 10.1039/b917103g.
- ↑ W.B. DeMore, C.W. Jacobsen. Formation of carbon trioxide in the photolysis of ozone in liquid carbon dioxide. „Journal of Physical Chemistry”. 9 (73), s. 2935–2938, 1969. DOI: 10.1021/j100843a026.
- ↑ Herman F. Cordes, Herbert P. Richter, Carl A. Heller. Mass spectrometric evidence for the existence of 1,2-dioxetanedione (carbon dioxide dimer). Chemiluminescent intermediate. „J. Am. Chem. Soc.”. 91 (25), s. 7209, 1969. DOI: 10.1021/ja01053a065.
- ↑ Corey S. Jamieson, Alexander M. Mebel, Ralf I. Kaiser. Novel detection of the C-2v isomer of carbon tetraoxide (CO4). „Chemical Physics Letters”. 1–3 (440), s. 105–109, 2007. DOI: 10.1016/j.cplett.2007.04.043.
- ↑ H.M. Pickett, E.A. Cohen, B.J. Drouin, J.C. Pearson: Submillimeter, Millimeter, and Microwave Spectral Line Catalog. NASA/JPL, 2003. [dostęp 2009-07-11].
- ↑ a b c Detlef Schröder i inni, Ethylenedione: An Intrinsically Short-Lived Molecule, „Chemistry – A European Journal”, 12 (4), 1998, s. 2550–2557, DOI: 10.1002/(SICI)1521-3765(19981204)4:12<2550::AID-CHEM2550>3.0.CO;2-E.
- ↑ Haijun Jiao, Hai-Shun Wu. Are Neutral Oxocarbons Stable?. „J. Org. Chem.”. 68, s. 1475–1479, 2003. DOI: 10.1021/jo026243m.
- ↑ a b Errol Lewars. Polymers and oligomers of carbon dioxide: ab initio and semiempirical calculations. „Journal of Molecular Structure: THEOCHEM”. 363 (1), s. 1–15, 1996. DOI: 10.1016/0166-1280(95)04420-5.
- ↑ Matthew L. Shirel, Peter Pulay. Stability of Novel Oxo- and Chloro-Substituted Trioxanes. „J. Am. Chem. Soc.”. 121 (37), s. 8544–8548, 1999. DOI: 10.1021/ja984451j.
- ↑ a b c d A.W. Snow, H. Haubenstock, N.-L. Yang. Poly(carbon suboxide). Characterization, Polymerization, and Radical Structure. „Macromolecules”. 11 (1), s. 77–86, 1978. DOI: 10.1021/ma60061a015.
- ↑ Maier Günther, Hans Peter Reisenauer, Heinz Balli, Willy Brandt i inni. C4O2 (1,2,3-Butatriene-1,4-dione), the First Dioxide of Carbon with an Even Number of C Atoms. „Angewandte Chemie International Edition in English”. 29 (8), s. 905–908, 1990. DOI: 10.1002/anie.199009051.
- ↑ Maier Günther, Hans Peter Reisenauer, Ulrich Schäfer, Heinz Balli. C5O2 (1,2,3,4-Pentatetraene-1,5-dione), a New Oxide of Carbon. „Angewandte Chemie International Edition in English”. 4 (27), 1988. DOI: 10.1002/anie.198805661.
- ↑ a b c Frank W. Eastwood: Gas Phase Pyrolytic Methods for the Preparation of Carbon-Hydrogen and Carbon-Hydrogen-Oxygen Compounds. W: Yannick Vallée: Gas Phase Reactions in Organic Synthesis. CRC Press, 1997, s. 97. ISBN 978-90-5699-081-7.
- ↑ Roman Reusch: Absorptionsspektroskopie von langen Kohlenstoff-Kettenmolekülen und deren Oxide in kryogenen Matrizen. Inaugural – Dissertation zur Erlangung der Doktorwürde der Naturwissenschaftlich-Mathematischen Gesamtfakultät Der Ruprecht-Karls-Universität Heidelberg, 2005, s. 95. [dostęp 2012-06-26].
- ↑ Günter Maier, Hans Peter Reisenauer: Carbenes in Matrices: Specrospcopy, Structure, and Photochemical Behavior. W: Advances in carbene chemistry. Udo H. Brinker (red.). Elsevier, 2001, s. 135. ISBN 978-0-444-50892-8.
- ↑ a b c Teruhiko Ogata, Yoshio Tatamitani. The Simplest Linear-Carbon-Chain Growth by Atomic-Carbon Addition and Ring Opening Reactions. „J. Phys. Chem. A”. 112 (43), s. 10713–10715, 2008. DOI: 10.1021/jp806725s.
- ↑ Einführung in die Theoretische Chemie. Wiley-VCH, 2002. ISBN 3-527-30609-9.
- ↑ a b Gunther Seitz, Peter Imming. Oxocarbons and pseudooxocarbons. „Chem. Rev.”. 6 (92), s. 1227–1260, 1992. DOI: 10.1021/cr00014a004.
- ↑ Detlef Schröder, Helmut Schwarz, Suresh Dua, Stephen J. Blanksby i inni. Mass spectrometric studies of the oxocarbons CnOn (n = 3–6). „International Journal of Mass Spectrometry”. 1–2 (188), s. 17–25, 1999. DOI: 10.1016/S1387-3806(98)14208-2.
- ↑ Werner Büchner, E. Weiss. Zur Kenntnis der sogenannten «Alkalicarbonyle» I Die Kristallstruktur des Kalium-acetylendiolats, KOC≡COK. „Helvetica Chimica Acta”. 46 (4), s. 1121–1127, 1963. DOI: 10.1002/hlca.19630460404.
- ↑ David Eggerding, Robert West. Synthesis of Dihydroxycyclopropenone (Deltic Acid). „J. American Chemical Society”. 97 (1), s. 207–208, 1975. DOI: 10.1021/ja00834a047.
- ↑ David Eggerding, Robert West. Synthesis and Properties of Deltic Acid (Dihydroxycyclopropenone) and the Deltate Ion. „J. American Chemical Society”. 98, s. 3641–3644, 1976. DOI: 10.1021/ja00428a043.
- ↑ Sidney Cohen, John R. Lacher, Joseph D. Park. Diketocyclobutanediol. „J. American Chemical Society”. 81, s. 3480, 1959. DOI: 10.1021/ja01522a083.
- ↑
 Leopold Gmelin. Ueber einige merkwürdige, bei der Darstellung des Kaliums nach der Brunner'schen Methode, erhaltene Substanzen. „Poggendorfs Annalen der Physik und Chemie”. 4, s. 31, 1825. [dostęp 2016-09-04].
Leopold Gmelin. Ueber einige merkwürdige, bei der Darstellung des Kaliums nach der Brunner'schen Methode, erhaltene Substanzen. „Poggendorfs Annalen der Physik und Chemie”. 4, s. 31, 1825. [dostęp 2016-09-04]. - ↑
 Johann Florian Heller. Die Rhodizonsäure, eine aus den Produkten der Kaliumbereitung gewonnene neue Säure, und ihre chemischen Verhältnisse. „Justus Liebigs Annalen der Pharmacie”. 24 (1), s. 1–16, 1837. [dostęp 2016-09-04].
Johann Florian Heller. Die Rhodizonsäure, eine aus den Produkten der Kaliumbereitung gewonnene neue Säure, und ihre chemischen Verhältnisse. „Justus Liebigs Annalen der Pharmacie”. 24 (1), s. 1–16, 1837. [dostęp 2016-09-04]. - ↑ Carl Löwig: Chemie der organischen Verbindungen''. Zürich: F. Schultess, 1839.
- ↑ Haiyan Chen i inni, Lithium Salt of Tetrahydroxybenzoquinone: Toward the Development of a Sustainable Li-Ion Battery, „Journal of the American Chemical Society”, 131 (25), 2009, s. 8984–8988, DOI: 10.1021/ja9024897.
- ↑ R. West, J. Niu: Non-benzenoid aromatics. J. Snyder (red.). T. 1. New York: Academic Press, 1969.
- ↑ P.v.R. Schleyer, K. Najafian, B. Kiran, H. Jiao. Are Oxocarbon Dianions Aromatic?. „J. Org. Chem.”. 2 (65), s. 426–431, 2000. DOI: 10.1021/jo991267n.
- ↑ H.S. Verter, R. Dominic. A new carbon oxide. Synthesis of hexahydroxybenzene tris oxalate. „Tetrahedron”. 23 (10), s. 3863–3864, 1967. DOI: 10.1016/S0040-4020(01)97894-9.
- ↑ H.S. Verter, H. Porter, R. Dominic. A new carbon oxide: synthesis of tetrahydroxybenzoquinone bisoxalate. „Chemical Communications (London)”, s. 973b–974, 1968. DOI: 10.1039/C1968000973b.
- ↑ a b C. Nallaiah. Synthesis of tetrahydroxy-1,4-benzoquinone biscarbonate and hexahydroxybenzene triscarbonate – new organic carbon oxides. „Tetrahedron”. 40 (23), s. 4897–4900, 1984. DOI: 10.1016/S0040-4020(01)91324-9.
- ↑ Yves Rubin, Carolyn B. Knobler, Francois Diederich. Precursors to the cyclo[n]carbons: from 3,4-dialkynyl-3-cyclobutene-1,2-diones and 3,4-dialkynyl-3-cyclobutene-1,2-diols to cyclobutenodehydroannulenes and higher oxides of carbon. „J. Am. Chem. Soc.”. 4 (112), s. 1607–1617, 1990. DOI: 10.1021/ja00160a047.
- ↑ Paolo Strazzolini, Alberto Gambi, Angelo G. Giumanini, Hrvoj Vancik. The reaction between ethanedioyl (oxalyl) dihalides and Ag2C2O4: a route to Staudinger’s elusive ethanedioic (oxalic) acid anhydride. „J. Chem. Soc., Perkin Trans.”, s. 2553–2558, 1998. DOI: 10.1039/a803430c.
- ↑ Toshiyuki Hamura i inni, Dodecamethoxy- and Hexaoxotricyclobutabenzene: Synthesis and Characterization, „Journal of the American Chemical Society”, 128 (31), 2006, s. 10032–10033, DOI: 10.1021/ja064063e.
- ↑ Holger Butenschön. A new oxocarbon C12O6 via highly strained benzyne intermediates. „Angew Chem Int Ed Engl”, s. 4012–4014, 2007. DOI: 10.1002/anie.200700926.
- ↑ Diels, Otto, Wolf, Bertram. Ueber das Kohlensuboxyd. I. „Berichte der deutschen chemischen Gesellschaft”. 39 (1), s. 689-697, 1906. DOI: 10.1002/cber.190603901103. (niem.).
- ↑ B.D. Kybett, G.K. Johnson, C.K. Barker, J.L. Margrave. The Heats of Formation and Polymerization of Carbon Suboxide. „J. Phys. Chem.”. 69 (10), s. 3603–3606, 1965. DOI: 10.1021/j100894a060.
Media użyte na tej stronie
Molecular diagram of tetrakis(3,4-dialkynyl-3-cyclobutene-1,2-dione). For the oxocarbon Wikipedia article.
Molecular diagram of tetrahydroxy-1,4-benzoquinone bisoxalate. For the oxocarbon Wikipedia article.
Molecular diagram of tetrahydroxy-1,4-benzoquinone biscarbonate. For the oxocarbon Wikipedia article.
Molecular diagram of the hypothetical compound oxalic anhydride. For the oxocarbon Wikipedia article.
Molecular diagram of a four-unit oligomer of carbon suboxide. Ref: A. W. Snow, H. Haubenstock, and N.-L. Yang (1978), Poly(carbon suboxide). Characterization, Polymerization, and Radical Structure. Macromolecules, Vol. 11, No. 1, January-February 1978. doi: 10.1021/ma60061a015
Molecular diagram of 1,3-dioxetanedione. For the oxocarbon Wikipedia article.
Molecular diagram of carbon suboxide in the duble-bonded state. For the oxocarbon Wikipedia article.
Molecular diagram of a three-unit oligomer of carbon suboxide. Ref: A. W. Snow, H. Haubenstock, and N.-L. Yang (1978), Poly(carbon suboxide). Characterization, Polymerization, and Radical Structure. Macromolecules, Vol. 11, No. 1, January-February 1978. doi: 10.1021/ma60061a015
Molecular diagram of carbon monoxide in the triple-bond state (−C≡O+). For the oxocarbon Wikipedia article.
Molecular diagram of dioxane tetraketone. For the oxocarbon Wikipedia article.
Molecular diagram of the (almost?) hypothetical compound cyclohexanehexone (or cyclohexanehexaone). For the oxocarbon Wikipedia article.
Molecular diagram of carbon dioxide. For the oxocarbon Wikipedia article.
Molecular diagram of 1,3,5-trioxanetrione. For the oxocarbon Wikipedia article.
Molecular diagram of hexaphenol triscarbonate. For the oxocarbon Wikipedia article.
Molecular diagram of the hypothetical compound etylene dione. For the oxocarbon Wikipedia article.
Molecular diagram of the (almost?) hypothetical compound cyclopentanepentone (or cyclopentanepentaone). For the oxocarbon Wikipedia article.
Molecular diagram of a five-unit oligomer of carbon suboxide. Ref: A. W. Snow, H. Haubenstock, and N.-L. Yang (1978), Poly(carbon suboxide). Characterization, Polymerization, and Radical Structure. Macromolecules, Vol. 11, No. 1, January-February 1978. doi: 10.1021/ma60061a015
Molecular diagram of hexaoxotricyclobutabenzene. For the oxocarbon Wikipedia article.
Molecular diagram of 1,2-dioxetanedione. For the oxocarbon Wikipedia article.
Molecular diagram of the (almost?) hypothetical compound cyclobutanetetrone (or cyclobutanetetraone). For the oxocarbon Wikipedia article.
Molecular diagram of tris(3,4-dialkynyl-3-cyclobutene-1,2-dione). For the oxocarbon Wikipedia article.
Molecular diagram of hexaphenol trisoxalate. For the oxocarbon Wikipedia article.
Molecular diagram of a six-unit oligomer of carbon suboxide. Ref: A. W. Snow, H. Haubenstock, and N.-L. Yang (1978), Poly(carbon suboxide). Characterization, Polymerization, and Radical Structure. Macromolecules, Vol. 11, No. 1, January-February 1978. doi: 10.1021/ma60061a015
Molecular diagram of mellitic anhydride. For the oxocarbon Wikipedia article.
Molecular diagram of the (almost?) hypothetical compound cyclopropanetrione. For the oxocarbon Wikipedia article.
































