Tozinameran
| Ten artykuł należy dopracować |
Szczepionka Pfizer–BioNTech przeciw COVID-19, międzynarodowa nazwa niezastrzeżona tozinameran, nazwa handlowa Comirnaty, nazwa kodowa BNT162b2[1] – nowatorska szczepionka przeciw COVID-19 wyprodukowana w technologii szczepionek mRNA, opracowana przez przedsiębiorstwo BioNTech we współpracy z przedsiębiorstwem Pfizer. Substancją aktywną szczepionki jest tozinameran, zmodyfikowane mRNA (modRNA), kodujące zmodyfikowaną formę glikoproteiny powierzchniowej wirusa SARS-CoV-2, umieszczone wewnątrz nanocząstek lipidowych[2].
Jest pierwszą szczepionką na COVID-19, która została zatwierdzona do masowego wykorzystania. Szczepionka podawana jest w formie iniekcji domięśniowej i wymaga dwóch dawek podawanych w odstępie trzech tygodni[3].
Historia
Badania kliniczne zostały rozpoczęte w kwietniu 2020 roku. Do listopada 2020 roku szczepionka została przetestowana na ponad 43 tys. osób[4][5]. Wstępna analiza badania wykazała, że szczepionka może mieć nawet 95% skuteczności w zapobieganiu zakażenia w ciągu siedmiu dni od podania drugiej dawki. Szczepionka została przebadana na tysiącach osób i stwierdzono iż zwiększone ryzyko zapalenia mięśnia sercowego po podaniu szczepionki Comirnaty jest najwyższe u młodszych osób płci męskiej. W dwóch szeroko zakrojonych europejskich badaniach farmakoepidemiologicznych stwierdzono zwiększone ryzyko u młodszych osób płci męskiej po podaniu drugiej dawki szczepionki Comirnaty[6]. Nie określono dotychczas ryzyka zapalenia mięśnia sercowego po trzeciej dawce produktu leczniczego Comirnaty[7]. Szczepionka została zatwierdzona do stosowania w Unii Europejskiej przez Europejską Agencję Leków (EMA), w Stanach Zjednoczonych przez Agencję Żywności i Leków (FDA) oraz w Wielkiej Brytanii przez Agencję Regulacyjną Leków i Produktów Opieki Zdrowotnej (MHRA)[8][9][10]. Najczęstszymi skutkami ubocznymi są lekkie bóle i obrzęk w okolicy iniekcji, zmęczenie oraz ból głowy. Poważne efekty uboczne, takie jak reakcje alergiczne, były do tej pory bardzo rzadkie. Nie zostały odnotowane jakiekolwiek długoterminowe powikłania. Jej zdolność do zapobiegania zakażenia u dzieci, kobiet w ciąży oraz osób z niedoborami odporności, jak również czas trwania działania immunologicznego jest aktualnie nieznany[11][12]. Informacje na temat tych szczególnych przypadków, będą stopniowo uzyskiwane wraz z trwaniem badania klinicznego.
W grudniu 2020 roku tozinameran był w trakcie oceny pod kątem dopuszczenia do powszechnego stosowania w nagłych wypadkach, przez kilka światowych organów regulacyjnych ds. leków. Dopuszczenie do stosowania w nagłych wypadkach jest wymagane, ponieważ badania III fazy, prowadzone w sześciu krajach, mają monitorować wyniki pierwotne do sierpnia 2021, a wyniki wtórne do stycznia 2023 roku. Wielka Brytania była pierwszym krajem, który autoryzował szczepionkę na zasadzie użycia w nagłych wypadkach. W kolejnych krajach, takich jak Kanada, Kuwejt, Bahrajn, Arabia Saudyjska, Meksyk, Singapur, została zatwierdzona w ciągu tygodnia[13][14][15][16][17]. Do 16 grudnia 2020 roku, w Wielkiej Brytanii, w ramach narodowego programu szczepiennego zaszczepionych zostało 138 tys. osób.
BioNTech jest twórcą szczepionki, natomiast Pfizer zapewnia logistykę, finanse i nadzór nad badaniami klinicznymi oraz jest partnerem produkcyjnym BNT162b2 na całym świecie, z wyjątkiem Chin, gdzie licencja na dystrybucję i produkcję została zakupiona przez Fosun[18]. W listopadzie 2020 roku przedsiębiorstwo Pfizer wskazało, że do końca 2020 roku na świecie może być dostępnych 50 mln dawek i 1,3 mld dawek do połowy 2021 roku[11]. Pfizer ma aktualnie podpisane umowy zakupu szczepionki w wysokości ok. 3 mld USD na dostarczenie licencjonowanej szczepionki w Stanach Zjednoczonych, Unii Europejskiej, Wielkiej Brytanii, Japonii, Kanadzie i Peru. Dystrybucja i przechowywanie BNT162b2 jest globalnym wyzwaniem logistycznym, ponieważ do kilku godzin przed każdym z dwóch wymaganych szczepień, szczepionka mRNA musi być przechowywana w temperaturze od –80 °C do –60 °C[19], mimo to w ulotce szczepionki Comirnaty można znaleźć informację, że dopuszczalne jest przechowywanie szczepionki w temperaturze 2–8 °C przez okres do 5 dni[20], co już jest mniejszym wyzwaniem logistycznym.
11 października 2022 r. prezes ds. rynków międzynarodowych firmy Pfizer, Janine Small, przyznała przed komisją Specjalną Parlamentu Europejskiego, że szczepionka sprzedawana przez Pfizer i BioNTech nie została przetestowana pod kątem przenoszenia COVID-19.[21][22][23] Robert Roos, zastępca członka Europejskiej Grupy Konserwatystów i Reformatorów, umieścił później odpowiedź wideo kobiety na swoim koncie na Twitterze, stwierdzając również, że „podstawa prawna paszportu COVID została wyrzucona [przez te oświadczenia]”[21][24].
Opracowanie i finansowanie
Szczepionka na chorobę zakaźną nigdy wcześniej nie została wyprodukowana w krótszym czasie niż kilka lat, na początku 2020 roku nie istniała też jak dotąd żadna szczepionka przeciwko chorobie wywołanej przez koronawirus u ludzi[25]. W tym czasie istniał już szereg szczepionek na wywołane koronawirusami choroby zwierzęce, w tym zakaźne zapalenie oskrzeli kur czy infekcje wywoływane przez koronawirusy wśród krów, psów, kotów i świń[26].
Po odkryciu nowej odmiany koronawirusa, w grudniu 2019 roku, rozpoczęto prace nad jego sekwencjonowaniem[27][28]. 12 stycznia 2020 roku Chiny przekazały Światowej Organizacji Zdrowia sekwencję genetyczną wirusa SARS-CoV-2, przyczyniając się do przyspieszenia międzynarodowej współpracy nad stworzeniem profilaktycznej szczepionki na COVID-19[29]. W styczniu 2020 roku niemieckie przedsiębiorstwo biotechnologiczne BioNTech rozpoczęło swój program „Lightspeed”, mający na celu opracowanie szczepionki przeciwko COVID-19, na bazie technologii mRNA. W laboratorium w Moguncji zostały stworzone różne warianty szczepionki, spośród których wytypowano 20, które przedstawiono ekspertom w Instytucie Paula Ehrlicha w Langen.
Badanie fazy I/II w Niemczech, w którym udział wzięły cztery warianty szczepionki (BNT162a1, BNT162b1, BNT162b2 i BNT162c2), zostało rozpoczęte 23 kwietnia 2020 roku[30]. Uczestniczyło w nim 456 osób, a szczepionka podawana była poszczególnym kohortom w dawkach 1 µg, 10 µg, 20 µg i 30 µg. Wariant 30 µg został wybrany jako kandydat do dalszych badań.
Badanie fazy I/II/III w Stanach Zjednoczonych zostało rozpoczęte 4 maja 2020 roku i składało się z dwóch części[5]. W fazie I udział wzięło 195 osób, testowano dwa warianty szczepionki (BNT162b1 i BNT162b2)[2]. Oba warianty były testowane na grupach osób w wieku 18–55 lat i 65–85 lat, w dwóch dawkach po 10 µg, 20 µg lub 30 µg, podawanych w odstępie 21 dni. BNT162b2 dodatkowo została przetestowana w jednorazowym podaniu w dawce 100 µg. W toku fazy I, jako kandydata do fazy II/III, wytypowano BNT162b2 w dawce 30 µg. W fazie II/III, która rozpoczęła się w lipcu 2020 roku, udział wzięło 43 448 osób, które przyjęły BNT162b2, lub placebo[4]. Rezultaty fazy III, które wskazały na 95% skuteczności BNT162b2, opublikowane zostały w listopadzie 2020 roku.
W marcu 2020 roku BioNTech otrzymało inwestycję w wysokości 135 mln USD od przedsiębiorstwa Fosun, w zamian za 1,58 mln udziałów w BioNTech oraz w przyszłości, prawa do tworzenia i marketingu BNT162b2 w Chinach, Hongkongu, Makau i Tajwanie[18]. We wrześniu 2020 roku, niemiecki rząd przyznał BioNTech 375 mln euro na rozwój programu szczepionki[31]. W tym czasie Pfizer pokrywał część kosztów związanych z jej opracowaniem. BioNTech otrzymało też finansowanie od Komisji Europejskiej oraz Europejskiego Banku Inwestycyjnego, sfinalizowane w czerwcu 2020 roku[32].
Technologia szczepionki
Technologia szczepionki BioNTech oparta jest na użyciu zmodyfikowanego mRNA (modRNA), które koduje części glikoproteiny, znajdującej się na powierzchni wirusa SARS-CoV-2, co wywołuje odpowiedź immunologiczną przeciwko białkom wirusa.
BNT162b2 zostało wybrane przez BioNTech spośród czterech różnych wariantów szczepionki. W trakcie badań klinicznych fazy I BNT162b2 wyróżniło się bezpieczeństwem i mniejszą częstością występowania działań niepożądanych niż pozostałe warianty[2].
Sekwencja
Sekwencja modRNA tozinameranu ma 4284 nukleotydy długości i masę około 1388 kDa. Nie zawiera urydyny, która zastąpiona została 1-metylo-3′-pseudourydyną. Sekwencja składa się z[33]:
- czapeczki 5′ (m7G – metylowana guanina) (zasada 0)
- regionu 5′ niepodlegającemu translacji, pochodzącemu z ludzkiej alfa-globiny (5′UTR) (zasady 1-54)
- regionu kodującego białko sygnałowe (zasady 55-102)
- sekwencji kodującej zmodyfikowaną wersję glikopeptydu powierzchniowego wirusa SARS-CoV-2 zawierającej dwie substytucje proliny (K986P i V987P oznaczone jako "P2 S"). Te dwie mutacje zapewniają, że białko S pozostaje w antygenowo optymalnej konformacji sprzed fuzji. (zasady 103-3879)
- regionu 3′ niepodlegającemu translacji (3′UTR) (zasady 3880-4174)
- ogona poli(A), zawierającego 30 zasad adenozyny, sekwencję 10 nukleotydów łączących oraz 70 zasad adenozyny (zasady 4175-4284)
Na dzień 3 stycznia 2021 roku, producent nie podał do publicznej wiadomości jednoznacznej struktury nukleotydowej ani chemicznej tozinameranu (składnika czynnego szczepionki Comirnaty) mimo dopuszczenia leku do użytku[34][35], co może utrudniać sprawdzenie jakości produktu w drodze badań jakości przez polskie podmioty kontrolne (np.: Główny Inspektorat Farmaceutyczny). Dostępny jest jedynie ogólny opis tozinameranu[35].
Skład
Szczepionka zawiera następujące nieaktywne substancje pomocnicze[33][36][37][20]:
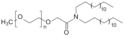
- ALC-0315 – bis(2-heksylodekanian) ((4-hydroksybutylo)azanodiylo)bis(heksano-6,1-diylu)
- ALC-0315 jest lipidem kationowym i jest niezbędny w procesie tworzenia się nanocząstek lipidowych (liposomów). Ma właściwości ułatwiające wniknięcie nanocząstki do wnętrza komórek i uwolnienie z niej mRNA do cytozolu komórki.
- W procesie tworzenia szczepionki, do wodnego roztworu mRNA dodaje się etanolowy roztwór mieszaniny lipidów, zawierający m.in. ALC-0315. ALC-0315 jest aminą o właściwościach zasadowych i oddziałuje z ujemnie naładowanymi grupami fosforanowymi cząsteczek mRNA. Skutkuje to otoczeniem mRNA przez ALC-0315 i w rezultacie uformowanie się nanocząstki lipidowej zawierającej w środku mRNA.
- ALC-0315 jest lipidem kationowym i jest niezbędny w procesie tworzenia się nanocząstek lipidowych (liposomów). Ma właściwości ułatwiające wniknięcie nanocząstki do wnętrza komórek i uwolnienie z niej mRNA do cytozolu komórki.
- ALC-0159 – 2-[(glikol polietylenowy)-2000]-N,N-ditetradecyloacetamid
- ALC-00159 jest lipidem PEG-ylowanym, którego funkcją jest utworzenie powłoki hydrofilowej, która stabilizuje nanocząstkę lipidową i zapobiega nieswoistemu wiązaniu się z białkami. Poprawia to stabilność szczepionki i ułatwia jej przechowywanie.
- DSPC – 1,2-distearoylo-sn-glycero-3-fosfocholina
- DSCP jest fosfolipidem dodawanym w celu stabilizacji struktury dwuwarstwy lipidowej nanocząstki. Lipidy kationowe (ALC-0315) mają tendencję do tworzenia struktur niedwuwarstwowych, czemu zapobiega dodanie DSCP.
- Cholesterol
- Cholesterol poprawia mobilność cząsteczek lipidów w obrębie dwuwarstwy lipidowej, co przyczynia się do stabilizacji struktury nanocząstki lipidowej.
- Sole nieorganiczne: wodorofosforan sodu Na
2HPO
4, diwodorofosforan potasu KH
2PO
4, chlorek potasu, KCl, chlorek sodu NaCl. - Sacharoza
- Woda do iniekcji
Bezpośrednio przed podaniem, szczepionkę ogrzewa się do temperatury pokojowej i rozcieńcza roztworem soli fizjologicznej[33][38].
Proces produkcyjny
Pfizer produkuje szczepionkę we własnych ośrodkach w trzyfazowym procesie[39].
W pierwszej fazie odbywającej się w laboratorium w Saint Louis, przeprowadza się klonowanie plazmidów DNA kodujących glikoproteinę powierzchniową, poprzez wstrzyknięcie ich do bakterii Escherichia coli. Po czterech dniach wzrostu bakterie są zabijane i rozbijane, a zawartość ich komórek jest oczyszczana przez półtora tygodnia, aby uzyskać pożądane DNA. Następnie DNA jest przechowywane we fiolkach i zamrażane do transportu. Bezpieczne i szybkie przewiezienie DNA na tym etapie jest tak ważne, że Pfizer używa do transportu firmowego odrzutowca i helikoptera[39].
Druga faza przeprowadzana jest w fabrykach w Andover, Massachusetts i w Niemczech. DNA jest używane jako matryca do budowy pożądanego mRNA. Kiedy mRNA jest już wytworzone i oczyszczone, zostaje zamrożone w plastikowych torbach. Jedna torba mieści od 5 do 10 milionów dawek szczepionki. Torby są następnie transportowane ciężarówkami do następnej fabryki[39].
Trzecia faza przeprowadzana jest w Kalamazoo w Michigan i w Puurs, w Belgii. W tej fazie odbywa się łączenie mRNA z lipidami, wypełnianie fiolek, pakowanie fiolek i mrożenie ich. Dostawcą niezbędnych lipidów jest Avanti Polar Lipids, spółka zależna Croda International. Etapem najbardziej ograniczającym cały proces produkcyjny jest łączenie mRNA z lipidami[39].
Przypisy
- ↑ Nimrat Khehra i inni, Tozinameran (BNT162b2) Vaccine: The Journey from Preclinical Research to Clinical Trials and Authorization, „AAPS PharmSciTech”, 22 (5), 2021, s. 172, DOI: 10.1208/s12249-021-02058-y, PMID: 34100150, PMCID: PMC8184133 [dostęp 2021-09-02] (ang.).
- ↑ a b c Edward E. Walsh i inni, Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates, „The New England Journal of Medicine”, 383 (25), 2020, s. 2439-2450, DOI: 10.1056/NEJMoa2027906, PMID: 33053279, PMCID: PMC7583697 [dostęp 2020-12-22] (ang.).
- ↑ Comirnaty koncentrat do sporządzania dyspersji do wstrzykiwań. Charakterystyka produktu leczniczego, Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych [dostęp 2021-04-06].
- ↑ a b Fernando P. Polack i inni, Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine, „The New England Journal of Medicine”, 0 (0), 2020, DOI: 10.1056/NEJMoa2034577, ISSN 0028-4793, PMID: 33301246, PMCID: PMC7745181 [dostęp 2020-12-22].
- ↑ a b Study to Describe the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Individuals – Full Text View – ClinicalTrials.gov, clinicaltrials.gov [dostęp 2020-12-22] (ang.).
- ↑ Opis wybranych działań niepożądanych, [w:] "Charakterystyka Produktu Leczniczego Comirnaty", BioNTech Manufacturing GmbH, Pfizer, 9 grudnia 2021 [dostęp 2022-01-06].
- ↑ Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania, [w:] Charakterystyka Produktu Leczniczego Comirnaty, BioNTech Manufacturing GmbH, Pfizer, 9 grudnia 2021 [dostęp 2022-01-06].
- ↑ Office of the Commissioner, FDA Takes Additional Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for Second COVID-19 Vaccine, FDA, 21 grudnia 2020 [dostęp 2020-12-22] (ang.).
- ↑ EMA recommends first COVID-19 vaccine for authorisation in the EU | European Medicines Agency, ema.europa.eu [dostęp 2020-12-23] (ang.).
- ↑ Coronavirus (COVID-19) vaccine, nhs.uk, 26 listopada 2020 [dostęp 2020-12-22] (ang.).
- ↑ a b Covid-19 vaccine from Pfizer and BioNTech is strongly effective, data show, STAT, 9 listopada 2020 [dostęp 2020-12-22] (ang.).
- ↑ Despite promise, many questions remain about Pfizer’s Covid-19 vaccine, NBC News [dostęp 2020-12-22] (ang.).
- ↑ Drug Details, covid-vaccine.canada.ca [dostęp 2020-12-22].
- ↑ Bahrain becomes second country to approve Pfizer COVID-19 vaccine, www.aljazeera.com [dostęp 2020-12-22] (ang.).
- ↑ Coronavirus: Saudi Arabia approves Pfizer-BioNTech COVID-19 vaccine for use, Al Arabiya English, 10 grudnia 2020 [dostęp 2020-12-22] (ang.).
- ↑ Mexico approves emergency use of Pfizer’s COVID-19 vaccine, „Reuters”, 12 grudnia 2020 [dostęp 2020-12-22] (ang.).
- ↑ First shipments of Pfizer-BioNTech vaccine in Singapore by end-Dec; enough vaccines for all by Q3 2021, The Straits Times, 14 grudnia 2020 [dostęp 2020-12-22] (ang.).
- ↑ a b BioNTech in China alliance with Fosun over coronavirus vaccine candidate, „Reuters”, 16 marca 2020 [dostęp 2020-12-22] (ang.).
- ↑ Deep-Freeze Hurdle Makes Pfizer’s Vaccine One for the Rich, „Bloomberg.com”, 10 listopada 2020 [dostęp 2020-12-22] (ang.).
- ↑ a b https://www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information_pl.pdf
- ↑ a b Mario Lotmore, Bombshell: Pfizer Exec admits COVID vaccine never tested on preventing transmissions, Lynnwood Times, 11 października 2022 [dostęp 2022-10-18] (ang.).
- ↑ Posts mislead on Pfizer COVID vaccine’s impact on transmission, AP NEWS, 13 października 2022 [dostęp 2022-10-18] (ang.).
- ↑ Frank Chung, Yes, they claimed the vaccines would prevent transmission, „news.com.au”, 17 października 2022 (ang.).
- ↑ Rob Roos, Breaking, Twitter [dostęp 2022-10-18].
- ↑ Bill Gates, What you need to know about the COVID-19 vaccine, gatesnotes.com, 30 kwietnia 2020 [dostęp 2021-01-12].
- ↑ Dave Cavanagh, Severe acute respiratory syndrome vaccine development: experiences of vaccination against avian infectious bronchitis coronavirus, „Avian Pathology”, 32 (6), 2010, s. 567–582, DOI: 10.1080/03079450310001621198, ISSN 0307-9457, PMID: 14676007, PMCID: PMC7154303 [dostęp 2021-01-12] (ang.).
- ↑ Archived: WHO Timeline – COVID-19, www.who.int [dostęp 2020-12-22] (ang.).
- ↑ Tung Thanh Le i inni, The COVID-19 vaccine development landscape, „Nature Reviews. Drug Discovery”, 19 (5), 2020, s. 305–306, DOI: 10.1038/d41573-020-00073-5, PMID: 32273591 [dostęp 2021-03-30] (ang.).
- ↑ Novel Coronavirus – China, WHO, 12 stycznia 2020 [dostęp 2021-01-12] (ang.).
- ↑ BioNTech RNA Pharmaceuticals GmbH, A Multi-site, Phase I/II, 2-Part, Dose-Escalation Trial Investigating the Safety and Immunogenicity of Four Prophylactic SARS-CoV-2 RNA Vaccines Against COVID-2019 Using Different Dosing Regimens in Healthy Adults, 10 września 2020 [dostęp 2020-12-21].
- ↑ BioNTech Gets $445 Million in German Funding for Vaccine, „Bloomberg.com”, 15 września 2020 [dostęp 2020-12-22] (ang.).
- ↑ Investment Plan for Europe: European Investment Bank to provide BioNTech with up to €100 million in debt financing for COVID-19 vaccine development and manufacturing, European Investment Bank [dostęp 2020-12-22] (ang.).
- ↑ a b c https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/944544/COVID-19_mRNA_Vaccine_BNT162b2__UKPAR___PFIZER_BIONTECH__15Dec2020.pdf
- ↑ 5085ZFP6SJ, [w:] PubChem [online], United States National Library of Medicine, SID: 434370509 [dostęp 2021-03-30] (ang.).
- ↑ a b https://www.who.int/docs/default-source/international-nonproprietary-names-(inn)/pl124-covid.pdf?sfvrsn=7fa357f8_9&download=true
- ↑ Information for Healthcare Professionals on Pfizer/BioNTech COVID-19 vaccine, GOV.UK [dostęp 2020-12-24] (ang.).
- ↑ Information for UK recipients on Pfizer/BioNTech COVID-19 vaccine, GOV.UK [dostęp 2020-12-24] (ang.).
- ↑ Pfizer-BioNTech COVID-19 Vaccine Fact Sheet for Healthcare Providers Administering Vaccine, The U.S. Food and Drug Administration (ang.).
- ↑ a b c d Carolyn Y. Johnson, A vial, a vaccine and hopes for slowing a pandemic — how a shot comes to be, „The Washington Post”, ISSN 0190-8286 [dostęp 2020-12-24] (ang.).
Media użyte na tej stronie
Autor: User:Spacepotato; crop of work by User:ChemDoc 2010, Licencja: CC BY-SA 4.0
Chemical structure of the lipid ALC-0159.
Autor: U.S. Secretary of Defense, Licencja: CC BY 2.0
Army Spc. Angel Laureano holds a vial of the COVID-19 vaccine, Walter Reed National Military Medical Center, Bethesda, Md., Dec. 14, 2020. (DoD photo by Lisa Ferdinando)
Autor: ChemDoc 2010, Licencja: CC BY-SA 4.0
Strukturformel des Lipids ALC-0315 zur Herstellung von Lipid-Nanopartikeln
Autor:
Various Commons editors. See file history for latest ones.
Older versions: Svenskbygderna (original author); Ratherous, AKS471883 (contributors); authors of File:BlankMap-World.svg (source file), Licencja: CC BY 4.0Map of the COVID-19 outbreak. Total cumulative confirmed COVID-19 cases by country. See the file history farther down for the latest upload date. Be aware that since this is a rapidly evolving situation, new cases may not be immediately represented visually. Refer to the primary article COVID-19 pandemic or the World Health Organization's situation reports for most recent reported case information.
Legend information: