Trichlorek fosforylu
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||
| Wzór sumaryczny | POCl3 | ||||||||||||||||||||||||||||
| Masa molowa | 153,33 g/mol | ||||||||||||||||||||||||||||
| Wygląd | bezbarwna ciecz[1] | ||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||
| Numer CAS | 10025-87-3 | ||||||||||||||||||||||||||||
| PubChem | 24813 | ||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Podobne związki | fosgen, dichlorek sulfurylu, dichlorek tionylu | ||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||
Trichlorek fosforylu, POCl
3 – nieorganiczny związek chemiczny z grupy chlorków kwasowych, zawierający grupę fosforylową P=O oraz trzy atomy chloru przyłączone do atomu fosforu.
Przemysłowo jest otrzymywany z trichlorku fosforu i tlenu lub pięciotlenku fosforu. Znajduje zastosowanie jako surowiec do otrzymywania fosforanów organicznych, katalizatorów, plastyfikatorów, środków chlorujących.
Budowa
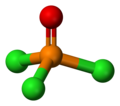
Podobnie jak fosforany, cząsteczka tego związku ma kształt tetraedru. Występują w niej trzy wiązania pojedyncze P−Cl oraz bardzo silne wiązanie podwójne P=O z szacowaną energią dysocjacji około 533,5 kJ/mol.

Własności chemiczne
Chlorek fosforylu to bezbarwna ciecz, dymiąca na powietrzu wskutek hydrolizy, powodującej powstanie kwasu fosforowego i duszących oparów kwasu solnego. Reaguje z wodą i alkoholami dając odpowiednio kwas fosforowy lub jego estry:
- O=PCl
3 + 3H
2O → O=P(OH)
3 + 3HCl- O=PCl
3 + 3ROH → O=P(OR)
3 + 3HCl- ROH oznacza alkohol
- O=PCl
Reakcje te często prowadzi się w obecności pirydyny lub amin neutralizujących wydzielający się chlorowodór.
Ogrzewanie z nadmiarem fenoli w obecności katalizatora będącego kwasem Lewisa, na przykład chlorku magnezu, daje fosforany triarylowe:
- 3ArOH + O=PCl
3 → O=P(OAr)
3 + 3HCl
Związek może również działać jako zasada Lewisa, tworząc addukty z kwasami Lewisa, jak na przykład z tetrachlorkiem tytanu:
- Cl
3P+
−O−
+ TiCl
4 → Cl
3P+
−O−
−TiCl
4
Addukt z chlorkiem glinu (POCl
3·AlCl
3) jest bardzo stabilny, w związku z tym POCl
3 można używać do dokładnego usuwania AlCl
3 ze środowiska reakcji Friedla-Craftsa. POCl
3 reaguje w obecności AlCl
3 z bromowodorem dając POBr
3.
Otrzymywanie
Związek można wytworzyć w reakcji trichlorku fosforu z tlenem w temperaturze od 20 do 25 °C (użycie powietrza nie jest skuteczne):
- 2PCl
3 + O
2 → 2O=PCl
3
Inną metodą syntezy jest reakcja pentachlorku fosforu (PCl
5) i dekatlenku tetrafosforu (P
4O
10). Ponieważ oba te związki są ciałami stałymi, reakcję przeprowadza się przez chlorowanie mieszaniny ciekłego PCl
3 z P
4O
10. Powoduje to powstanie PCl
5 in situ. W miarę zużywania PCl
3 rozpuszczalnikiem staje się wytworzony POCl
3:
- 6PCl
3 + 6Cl
2 → 6PCl
5- 6PCl
5 + P
4O
10 → 10POCl
3 - 6PCl
Obie te metody są stosowane przemysłowo[8].
Chlorek fosforu(V) w reakcji z jednym ekwiwalentem wody również daje POCl
3, ale reakcję tę jest trudniej kontrolować, gdyż POCl
3 może ulegać dalszej reakcji z wodą, zgodnie z dwuetapowym mechanizmem hydrolizy PCl
5[9]:
- PCl
5 + H
2O → POCl
3 + 2HCl- POCl
3 + 3H
2O → H
3PO
4 + 3HCl - POCl
Zastosowanie
Najważniejszym zastosowaniem tego związku jest wytwarzanie triarylowych fosforanów takich, jak fosforan trifenylu OP(OC
6H
5)
3 i trikrezolu OP(OC
6H
4CH
3)
3. Używane są one jako plastyfikatory PCW oraz substancje nadające ogniotrwałość. Fosforany trialkilowe, jak fosforan tributylu, są stosowane jako rozpuszczalniki w ekstrakcji ciecz-ciecz w przerobie zużytego paliwa jądrowego.
Przypisy
- ↑ a b c d e f Haynes 2016 ↓, s. 4-78.
- ↑ a b c Haynes 2016 ↓, s. 6-193.
- ↑ Haynes 2016 ↓, s. 15-19.
- ↑ a b Haynes 2016 ↓, s. 6-120.
- ↑ Haynes 2016 ↓, s. 9-65.
- ↑ Trichlorek fosforylu (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2017-08-29].
- ↑ Phosphorus oxychloride, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2017-08-29] (ang.).
- ↑ Fabien Caillé, Phosphorus Oxychloride, „Synlett”, 10, 2011, s. 1477–1478, DOI: 10.1055/s-0030-1260574 (ang.).
- ↑ Philip John Durrant, Bryl Durrant, Zarys współczesnej chemii nieorganicznej, Warszawa: Państwowe Wydawnictwo Naukowe, 1965, s. 834.
Bibliografia
- CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, ISBN 978-1-4987-5429-3.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Detailed structure of phosphorus oxychloride. Drawn in IsisDraw and scanned in by User:Walkerma, June 2005.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances