Węże
| Serpentes[1] | |||
| Linnaeus, 1758 | |||
| Okres istnienia: 167–dziś mln lat temu | |||
(c) Andrew Butko, CC BY-SA 3.0 Zaskroniec zwyczajny | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Podgromada | |||
| Nadrząd | |||
| Rząd | |||
| Podrząd | węże | ||
| Synonimy | |||
| |||
| Zasięg występowania | |||
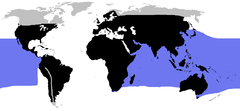 Występowanie węży lądowych (czarny) i morskich (niebieski) | |||
Węże (Serpentes) – podrząd gadów z rzędu łuskonośnych. Charakteryzują się wydłużonym, beznogim ciałem i aparatem szczękowym umożliwiającym niezwykle szerokie rozwarcie paszczy, a co za tym idzie połykanie ofiar w całości, brakiem błony bębenkowej i ucha środkowego. Liczba kręgów, które mają (podobnie jak u waranów) dodatkowe powierzchnie stawowe, może sięgać 400. Węże (jadowite i właściwe) mają tylko jedno (prawe) płuco (dusiciele mają dwa), wydłużoną wątrobę, nerki ułożone jedna za drugą. Mają dobrze rozwinięty narząd Jacobsona. Węże są grupą monofiletyczną. Rozmnażają się płciowo.
W bazie danych The Reptile Database 18 stycznia 2009 figurowało 3149 gatunków[2].
W Polsce występuje 5 gatunków:
- gniewosz plamisty (Coronella austriaca)
- wąż Eskulapa (Elaphe longissima)
- zaskroniec zwyczajny (Natrix natrix)
- zaskroniec rybołów[3] (Natrix tesselata)
- żmija zygzakowata (Vipera berus)
Węże są mięsożerne. Połykają ofiary w całości, mimo że często są one większe od samego węża. Połykanie polega na nasuwaniu się węża na swoją ofiarę. Jest to możliwe dzięki bardzo ruchliwej trzewioczaszce oraz specyficznemu ułożeniu podskórnych naczyń krwionośnych, które tworzą sieć zmieniających kształt rombów.
Wśród węży występują gatunki jadowite. Szacuje się, że stanowią one 10-25% wszystkich gatunków węży. Różnice w szacunkach pochodzą stąd, że niektóre węże uważa się za tzw. warunkowo jadowite (zęby jadowe położone w tyle szczęki, płytkie ukąszenie nie wprowadza więc jadu). Jad węży wytwarzany jest w specjalnym gruczole jadowym i spływa do ostrych zębów jadowych, którymi zwierzę uśmierca ofiarę.
Dział zoologii zajmujący się wężami to ofiologia.
Ewolucja
Filogeneza węży jest słabo poznana ponieważ ich szkielety są małe i kruche, co sprawia, że efekty procesu fosylizacji, jeśli już zachodzi, rzadko zachowały się do dnia dzisiejszego. Najstarszy znany wąż, Eophis underwoodi, został opisany na podstawie trzech fragmentów kości zębowych i fragmentu szczęki odkrytych w środkowojurajskich (baton) osadach formacji Forest Marble w Wielkiej Brytanii[4]. Odkryte w Ameryce Południowej i Afryce okazy liczące 150 milionów lat, zostały jasno rozpoznane jako węże z jaszczuropodobnymi strukturami szkieletowymi[5]. To potwierdzałoby, na podstawie morfologii, że węże wywodzą się od jaszczurek[5][6]. Materiał kopalny sugeruje, że węże mogły ewoluować z podziemnych jaszczurek, takich jak waranowate lub podobnej grupy[7]. Wczesny wąż kopalny, Najash rionegrina był dwunożnym, podziemnym zwierzęciem z kością krzyżową (łac.: os sacrum) i był gatunkiem w pełni lądowym[8]. Jeden wciąż żyjący, analogiczny do tego przypuszczalnego przodka jest pozbawiony uszu gatunek Lanthanotus borneensis z Borneo, chociaż jest on jednocześnie gatunkiem półwodnym[9]. Jako że ci przodkowie zaczęli prowadzić podziemny tryb życia, w wyniku ewolucji utracili kończyny, a ich ciała stały się bardziej opływowe, co było przystosowaniem do rycia w ziemi[9]. Zgodnie z tą hipotezą, cechy takie jak przeźroczyste, zrośnięte powieki i brak uszu zewnętrznych ewoluowały do walki w podziemnych warunkach, efektem czego są podrapane rogówki i brud w uszach[7][9]. Niektóre prymitywne węże posiadały tylne kończyny, ale nie miały bezpośredniego połączenia kości miednicznej z kręgami. Zaliczały się tu takie węże kopalne jak Haasiophis, Pachyrhachis i Eupodophis, które są nieco starsze niż Najash[10].
Wśród nowoczesnych węży pytony i boa mają szczątkowe tylne kończyny: małe, wyposażone w pazury palce znane jako analne ostrogi, które są wykorzystywane do chwytania partnera podczas kopulacji[5][10]. Rodziny Leptotyphlopidae i Typhlopidae są innymi przykładami, gdzie pozostałości pasa miednicznego nadal istnieją, czasami wyglądając jak rogowate wyrostki – jeśli są widoczne. Kończyny przednie nie występują u żadnych węży, a ich utrata jest związana z ewolucją genów homeotycznych, kontrolujących morfogenezę. Szkielet osiowy wspólnego przodka węży, jak większość innych czworonogów, miał regionalne specjalizacje składające się z kręgów szyjnych (szyi), tułowia (klatka piersiowa), kręgów lędźwiowych (dolna część pleców), kości krzyżowej (kość miedniczna) i kręgu ogonowego. Przejaw genu homeotycznego w szkielecie osiowym odpowiedzialnego za rozwój tułowia stał się dominujący na początku ewolucji węży, w rezultacie czego wszystkie kręgi znajdujące się przed zalążkami tylnych kończyn – jeśli występują – mają taki sam tułowiopodobny wygląd (z wyjątkiem dźwigacza, kręgu obrotowego i jednego do trzech kręgów szyjnych), dzięki czemu większość szkieletu węża stanowi ekstremalnie wydłużony tułów. Żebra znajdują się wyłącznie w części tułowiowej kręgosłupa i nie łączą się po stronie brzusznej, co daje możliwość rozciągania tułowia przy połykaniu dużych ofiar. Kręgi szyjne, lędźwiowe i miedniczne są bardzo zredukowane w liczbie (zachowały się tylko dwa do dziesięciu kręgów lędźwiowych i miednicznych), a zachowały się jedynie krótkie pozostałości kręgów ogonowych, chociaż ogon jest wciąż wystarczająco długi, by być używanym przez wiele gatunków i jest zmodyfikowany u niektórych wodnych i nadrzewnych gatunków węży.
Alternatywna hipoteza, bazująca na morfologii sugeruje, że przodkowie węży byli spokrewnieni z mozazaurami – wymarłymi gadami wodnymi z kredy – które z kolei, jak się przypuszcza, pochodzą od waranowatych[6]. Zgodnie z tą hipotezą zrośnięte, przezroczyste powieki zdają się być efektem ewolucji w kierunku walki w morskich warunkach (rogówkowa utrata wody przez osmozę), podczas gdy uszy zewnętrzne zostały utracone na skutek braku potrzeby ich używania w środowisku wodnym, co ostatecznie doprowadziło do zwierząt podobnych w wyglądzie do węży morskich żyjących współcześnie. W późnej kredzie, węże powtórnie skolonizowały lądy, głównie w takim stanie jakim dzisiaj występują. Szczątki węży kopalnych znane z osadów morskich z początku późnej kredy potwierdzają tę hipotezę, szczególnie, że są one starsze od lądowego Najash rionegrina. Podobne struktury czaszki, zredukowane/zanikłe kończyny i inne anatomiczne cechy spotykane zarówno u mozazaurów, jak i u węży prowadzą do prawidłowej kladystycznej korelacji, choć niektóre z tych cech są wspólne z waranowatymi. W ostatnich latach badania genetyczne wykazały, że węże nie są tak blisko spokrewnione z waranowatymi jak wcześniej sądzono, a więc i nie do mozazaurów, proponowanego przodka w wodnym scenariuszu ich ewolucji. Jednakże, istnieje więcej dowodów łączących mozazaury z wężami niż z waranowatymi. Fragmentaryczne pozostałości datowane od jury i wczesnej kredy wskazują na istnienie starszych skamieniałości przedstawicieli tych grup, które mogą ewentualnie obalić wcześniejszą hipotezę.
Niektóre analizy mtDNA sugerują, że grupą siostrzaną węży są amfisbeny, grupa beznogich łuskonośnych[11]. Podobne wyniki przynoszą również niektóre analizy morfologiczne[12][13]. Większość badań molekularnych wskazuje jednak na bliskie pokrewieństwo węży z kladami Iguania i Anguimorpha[14][15].
Ogromna różnorodność współczesnych węży pojawiła się w paleocenie, koreluje z radiacją adaptacyjną ssaków, która poprzedziła wyginięcie nieptasich dinozaurów. Jedna z najbardziej rozpowszechnionych współcześnie grup węży – połozowate (Colubridae), rozprzestrzeniły się szczególnie wraz z gryzoniami, grupą ssaków na które polują.
Występowanie
Istnieje ponad 3000 gatunków węży, rozprzestrzenionych na półkuli północnej aż po koło podbiegunowe w Skandynawii i na półkuli południowej po Australię i Tasmanię[6]. Węże występują na wszystkich kontynentach (z wyjątkiem Antarktydy), zarówno w morzu, jak i na wysokości 4900 m w Himalajach w Azji[6][16]. Istnieje wiele wysp, na których węże w ogóle nie występują, takich jak Irlandia, Islandia, czy Nowa Zelandia[16] (chociaż w wodach przybrzeżnych Nowej Zelandii sporadycznie pojawiają się pęz dwubarwny i wiosłogon żmijowaty)[17].
Taksonomia
Wszystkie współczesne węże są zgrupowane według taksonomii Linneusza w obrębie podrzędu Serpentes, będącego częścią rzędu Squamata, chociaż ich dokładne umiejscowienie w obrębie tego rzędu jest kontrowersyjne[1]. Wyróżniono dwa infrarzędy wchodzące w skład Serpentes: Alethinophidia i Scolecophidia[1]. Ten podział opiera się głównie na cechach morfologicznych oraz podobieństwie sekwencji DNA mitochondrialnego. Infrarząd Alethinophidia czasami jest rozdzielany na Henophidia oraz na Caenophidia, obejmujący węże „połozopodobne” (połozowate, żmijowate, zdradnicowate, węże morskie i gleboryjcowate) i brodawkowcowate, podczas gdy pozostałe rodziny infrarzędu Alethinophidia należą do parafiletycznej grupy Henophidia[18]. Przedstawiciele wymarłej rodziny olbrzymich, pytonopodobnych węży – Madtsoiidae – występowali od późnej kredy do plejstocenu na terenie Azji i Australii. Grupa Madtsoiidae reprezentowana była między innymi przez rodzaje Wonambi, Yurlunggur i Sanajeh[19].
Toczy się wiele dyskusji na temat systematyki w obrębie tej grupy. Na przykład wiele źródeł klasyfikuje rodzinę dusicieli (Boidae) i pytonów (Pythonidae) jako jedną rodzinę, podczas gdy niektóre trzymają zdradnicowate (Elapidae) i węże morskie (Hydrophiidae) oddzielnie ze względów praktycznych, mimo ich niezwykle bliskiego pokrewieństwa.
Rodziny
Rodziny węży grupowane są w dwóch infrarzędach: Scolecophidia i Alethinophidia[1]. Niekiedy z rodziny zdradnicowatych wydziela się osobną rodzinę węży morskich (Hydrophiidae), a z rodziny żmijowatych (Viperidae) wydzielana jest rodzina grzechotnikowatych (Crotalidae). Połozowate w tradycyjnym rozumieniu najprawdopodobniej są parafiletyczne, gdyż należą do nich przodkowie zdradnicowatych i żmijowatych, lecz nie same rodziny Elapidae i Viperidae; z tego powodu część autorów proponuje podnieść niektóre podrodziny Colubridae do rangi odrębnych rodzin[20][21][22][23]. Także Tropidophiidae w tradycyjnym rozumieniu mogą być parafiletyczne; niektóre analizy wskazują, że rodzaje Ungaliophis i Exiliboa nie są blisko spokrewnione z rodzajami Tropidophis i Trachyboa[24], lecz należą do dusicielowatych[25][26] lub tworzą odrębną rodzinę Ungaliophiidae[27].
| Alethinophidia (15 rodzin) | |||||
|---|---|---|---|---|---|
| Nazwa systematyczna[1] | Autor opisu taksonu[1] | Nazwa zwyczajowa | Przykładowy gatunek | Zasięg występowania[28] | Grafika |
| Acrochordidae | Bonaparte, 1831 | brodawkowcowate | brodawkowiec arafurski (Acrochordus arafurae) | Zachodnie Indie i Sri Lanka przez lasy tropikalne Azję Południowo-Wschodnią, Filipiny, Indonezję, Malezję, Timor i na wschód przez Nową Gwineę aż po północne wybrzeże Australii i Mussau Island (Archipelag Bismarcka), i wyspę Guadalcanal (Wyspy Salomona). | |
| Aniliidae | Stejneger, 1907 | cylindrowcowate | cylindrowiec koralowy (Anilius scytale) | Lasy tropikalne Ameryki Południowej. |  |
| Anomochilidae | Cundall, Wallach, 1993 | - | Anomochilus leonardi | Zachodnia Malezja i Sumatra. | |
| Atractaspididae | Günther, 1858 | gleboryjcowate | Amblyodipsas unicolor | Afryka i Bliski Wschód[5][29][30] |  |
| Boidae | Gray, 1825 | dusicielowate | boa dusiciel (Boa constrictor) | Obie Ameryki, Karaiby, Południowo-Wschodnia Europa, Azja Mniejsza, Północna, Środkowa i Wschodnia Afryka, Madagaskar, Reunion, Półwysep Arabski, Centralne i Południowo-Zachodnia Azja, Indie, Sri Lanka, Moluki, Nowa Gwinea, po Melanezję i Samoa. |  |
| Bolyeriidae | Hoffstetter, 1946 | - | Casarea dussumieri | Mauritius. |  |
| Colubridae | Oppel, 1811 | połozowate | zaskroniec zwyczajny (Natrix natrix) | Rozprzestrzeniony na wszystkich kontynentach, z wyjątkiem Antarktydy[31] |  |
| Cylindrophiidae | Fitzinger, 1843 | cylindrowężowate | Cylindrophis ruffus | Sri Lanka, Birma, Tajlandia, Kambodża, Wietnam i Archipelag Malajski, po Wyspy Aru na południowy zachód od Nowej Gwinei. Spotykany także w południowych Chinach (Fujian i Hajnan) oraz Laosie. |  |
| Elapidae | Boie, 1827 | zdradnicowate | kobra królewska (Ophiophagus hannah) | Lądowe gatunki rozprzestrzenione na całym świecie, w regionach tropikalnych i subtropikalnych, z wyjątkiem Europy. Węże morskie występują w Oceanie Indyjskim i Pacyfiku[32] |  |
| Loxocemidae | Cope, 1861 | pytoniakowate | Loxocemus bicolor | Wzdłuż wybrzeża Pacyfiku – od Meksyku po Kostarykę. |  |
| Pythonidae | Fitzinger, 1826 | pytony | pyton królewski (Python regius) | Afryka Subsaharyjska, Półwysep Indyjski, Birma, południowe Chiny, Południowo-Wschodnia Azja oraz od Filipin przez Indonezję po Nową Gwineę i Australię. | |
| Tropidophiidae | Brongersma, 1951 | boaszkowate | Tropidophis melanurus | Od południowego Meksyku przez Amerykę Środkową, po północno-zachodnią część Ameryki Południowej: kolumbię, amazońską część Ekwadoru i Peru oraz północno-zachodnią i południowo-wschodnią Brazylię. Spotykany także na Karaibach. |  |
| Uropeltidae | Müller, 1832 | tarczogonowate | Melanophidium bilineatum | Południowe Indie i Sri Lanka. |  |
| Viperidae | Oppel, 1811 | żmijowate | żmija zygzakowata (Vipera berus) | Obie Ameryki, Afryka i Eurazja. |  |
| Xenopeltidae | Bonaparte, 1845 | tęczowcowate | tęczowiec (Xenopeltis unicolor) | Azja Południowo-Wschodnia od Andamanów i Nikobary, przez Birmę po południowe Chiny, Tajlandię, Laos, Kabodżę, Wietnam, Półwysep Malajski oraz Indonezję, Borneo po Celebes, jak również Filipiny. |  |
| Scolecophidia (3 rodziny) | |||||
| Nazwa systematyczna[1] | Autor opisu taksonu[1] | Nazwa zwyczajowa | Przykładowy gatunek | Zasięg występowania[28] | Grafika |
| Anomalepidae | Taylor, 1939 | ociemkowate | Anomalepis mexicanus | Od Ameryki Środkowej po północno-zachodnią część Ameryki Południowej. Odizolowane populacje w północno-wschodniej i południowo-wschodniej Ameryce Południowej. | |
| Leptotyphlopidae | Stejneger, 1892 | węże nitkowate | Leptotyphlops dulcis | Afryka, zachodnia Azja od Turcji po północno-wschodnie Indie; Wyspa Sokotra; od południowo-zachodniej części USA przez Meksyk i Amerykę Środkową po południowe wybrzeża Peru, Urugwaju i Argentyny w Ameryce Południowej, w wyjątkiem wysokich partii Andów. Z wysp karaibskich występuje na Bahamach, Haiti i Małych Antylach. |  |
| Typhlopidae | Merrem, 1820 | ślepuchowate | Ramphotyphlops braminus | Większość tropikalnych i wiele subtropikalnych regionów na całym świecie, szczególnie w Afryce, na Madagaskarze, w Azji, na wyspach Pacyfiku, Ameryce Południowej i w południowo-wschodniej Europie. |  |
Uzębienie
Istnieją 4 typy uzębienia związane z typem aparatu jadowego (lub jego brakiem):
Aglypha – brak zębów jadowych. Występuje u większości węży. Węże o takim uzębieniu są w ogromnej większości niejadowite, istnieją jednak wyjątki. Niektóre jadowite Aglypha mają w tylnej części szczęki powiększone zęby. W odróżnieniu od zębów jadowych innych węży nie mają jednak żadnego rowka, a jad spływa po powierzchni zęba. Jedynym wężem z tej grupy, którego jad może być śmiertelny dla człowieka jest zaskroniec tygrysi (Rhabdophis tigrinus). Odnotowano kilka poważnych przypadków (w tym przynajmniej jeden śmiertelny) związanych z ukąszeniem przez ten gatunek. Aby ukąszenie było niebezpieczne konieczny jest jednak głęboki uchwyt, gdyż jad spływa jedynie po tylnych zębach, stąd nie każde ukąszenie kończy się wprowadzeniem jadu.
Opisthoglypha – spotykany u niektórych przedstawicieli połozowatych (ok. 30% gatunków tej rodziny). Umieszczone w tyle zęby jadowe zaopatrzone są w jedną lub więcej rynienek. Podobnie jak jadowite Aglypha węże te dla człowieka mogą być niebezpieczne jedynie gdy dosięgną ciała zębami jadowymi. Niekiedy Opisthoglypha i jadowite gatunki Aglypha traktuje się jako jedną kategorię. Większość węży o uzębieniu Opisthoglypha nie jest niebezpieczna dla ludzi. Ich jad wywołuje zazwyczaj objawy lokalne, a w cięższych przypadkach gorączkę i zawroty głowy. Jedynie 2 gatunki posiadają silny jad, powodujący ukąszenia śmiertelne dla człowieka. Są to dysfolid (Dispholidus typus), posiadający najsilniejszy jad oraz Thelotornis kirtlandi.
Proteroglypha – spotykany u zdradnicowatych i węży morskich. Krótkie zęby jadowe z przodu, zaopatrzone w rynienkę.
Solenoglypha – spotykany u żmijowatych i grzechotnikowatych. Zęby jadowe z przodu. Składają się przy zamykaniu pyska, mogą więc być dość długie. W zębie znajduje się kanalik, którym spływa jad.
Skóra
Skóra węża pokryta jest łuskami. W przeciwieństwie do popularnego poglądu, że wąż jest oślizgły spowodowanym możliwym kojarzeniem go z robakami, skóra węży ma gładką, suchą teksturę. Większość węży używa do przemieszczania się wyspecjalizowanych łusek brzusznych, ściskających powierzchnię, po której się porusza. Łuski mogą być gładkie, ziarniste lub posiadać podłużne wypukłości[33]. Powieki są przeźroczystymi „okularowymi” łuskami, które pozostają stale zamknięte.
Zrzucanie łusek nosi nazwę wylinki lub w powszechnym znaczeniu - linienia lub złuszczania. W przypadku węży, kompletna zewnętrzna warstwa skóry jest zrzucana za jednym razem[34]. Łuski węży nie są oddzielne lecz stanowią rozciągliwy naskórek, więc nie są zrzucane osobno, ale w całości jako kompletna, przyległa, zewnętrzna warstwa skóry podczas każdego linienia, podobnie jak zdejmowana skarpetka przewrócona na lewą stronę[35].
Kształt i liczba łusek na głowie, grzbiecie i brzuchu charakteryzują poszczególną rodzinę, rodzaj i gatunek. Łuski posiadają nomenklaturę analogiczną do pozycji na ciele. U „zaawansowanych” węży (Caenophidia), obszerne łuski brzuszne i rzędy łusek grzbietowych korelują z układem kręgów, pozwalając naukowcom liczyć ich kręgi bez konieczności wykonywania sekcji zwłok.
Oczy węży są u większości gatunków pokryte przeźroczystymi łuskami, rzadziej ruchomymi powiekami, dlatego jego oczy są zawsze otwarte, a w czasie spania siatkówka może być zamykana.
Linienie
Linienie pełni szereg funkcji - po pierwsze, stara i zużyta skóra jest zmieniana, po drugie, pomaga pozbyć się pasożytów, takich jak roztocze (w tym kleszcze). Odnowa skóry poprzez linienie umożliwia wzrost niektórych zwierząt, takich jak owady, jednak ten pogląd został zakwestionowany w przypadku węży[35][36].
Linienie jest cyklicznie powtarzane w ciągu całego życia węża. Przed linieniem, wąż przestaje jeść i często ukrywa się lub przenosi się w bezpieczne miejsce. Tuż przed zrzuceniem skóry, staje się ona matowa i sprawia wrażenie suchej, a oczy stają się mętne lub niebieskawe. Wewnętrzna powierzchnia starej zewnętrznej skóry ulega skropleniu. Powoduje to, że stara zewnętrzna skóra oddziela się od nowej skóry. Po kilku dniach, oczy stają się klarowne i wąż „wypełzuje” ze starej skóry. Stara skóra zostaje przerwana w okolicy pyska i wąż wywija się za pomocą tarcia o chropowate powierzchnie. W wielu przypadkach zrzucana skóra schodzi w jednym kawałku od głowy do ogona, podobnie jak stara skarpeta. Nowa, większa i jaśniejsza warstwa skóry formuje się pod spodem[35][37].
Starsze węże mogą pozbywać się swojej skóry tylko raz lub dwa razy w roku, ale młodsze, wciąż rosnące węże mogą zrzucać ją do czterech razy w roku[37]. Zrzucona skóra doskonale odciska wzór łusek i często możliwe jest zidentyfikowanie węża pod warunkiem, że zrzucona skóra jest wystarczająco kompletna i nienaruszona[35]. Ta ciągła, cykliczna odnowa sprawiła, że wąż stał się symbolem uzdrowienia i medycyny, co obrazuje laska Eskulapa[38].
Narządy wewnętrzne
Serce węża jest zamknięte w worku, zwanym osierdziowym, położonym na rozwidleniu oskrzeli. Serce może jednak się przemieszczać. Spowodowane jest to brakiem przepony. Takie rozwiązanie chroni serce przed potencjalnym uszkodzeniem, kiedy połykana duża ofiara przechodzi przez przełyk.
Śledziona jest przymocowana do pęcherzyka żółciowego i trzustki i ma za zadanie filtrować krew. Grasica znajduje się w tkance tłuszczowej powyżej serca i jest odpowiedzialna za wytwarzanie komórek układu immunologicznego we krwi. Układ sercowo-naczyniowy węży jest również unikatowy ze względu na obecność systemu portalu nerkowego, w którym krew z ogona węża przechodzi przez nerki, po czym wraca do serca[39].
Szczątkowe lewe płuco jest często małe lub nawet w ogóle nie występuje, gdyż podłużne ciało węży wymaga, aby wszystkie ich narządy były długie i cienkie[39]. U większości gatunków, tylko jedno płuco jest funkcjonalne. To płuco składa się z unaczynionej części przedniej i części tylnej, które nie biorą udziału w wymianie gazowej[39]. To „woreczkowate płuco” jest używane w celach hydrostatycznych do regulacji zdolności pływania u niektórych wodnych gatunków, a jego funkcja pozostaje nieznana u gatunków lądowych[39]. Wiele organów, które występują parzyście, takich jak nerki czy organy rozrodcze, są rozłożone wzdłuż ciała, jedno za drugim[39].
Węże nie posiadają węzłów chłonnych[39].
Jad
Kobry, żmije i blisko spokrewnione gatunki wykorzystują jad do unieruchamiania lub zabijania swoich ofiar. Jad jest zmodyfikowaną śliną, którą węże dostarczają przez kły[5]. Kły „zaawansowanych” węży jadowitych, takich jak żmije i zdradnicowate są wydrążone w celu skuteczniejszego wstrzykiwania jadu, podczas gdy u węży, których kły znajdują się z tyłu, jak u węża boomslang (Dispholidus typus) mają rowki na tylnej krawędzi do przekazywania jadu wprost do rany. Jad węży jest częściej używany do ataku, niż w celu samoobrony[5]. Jad, podobnie jak wszystkie ślinowe wydzieliny, ma zdolność trawienia wstępnego (tzw. przedtrawienia), które rozpoczyna rozkład pokarmu na składniki rozpuszczalne pozwalające na prawidłowe trawienie i nawet ugryzienia „niejadowitego” węża (podobnie, jak ugryzienie jakiegokolwiek zwierzęcia) powoduje uszkodzenie tkanek[5].
Niektóre ptaki, ssaki i inne węże, między innymi z rodzaju Lampropeltis, które polują na jadowite węże są wytrzymałe, a nawet odporne na określony jad[5]. Węże jadowite obejmują trzy rodziny węży i nie stanowią formalnej klasyfikacyjnej grupy stosowanej w taksonomii.
Termin węże trujące jest najczęściej nieprawidłowy - trucizna jest wdychana lub spożywana, podczas gdy jad jest wstrzykiwany[40]. Istnieją jednak dwa wyjątki – węże z rodzaju Rhabdophis, pochłaniają toksyny ropuch, które zjedzą, następnie wydzielają je z gruczołów karkowych w celu odparcia drapieżników oraz niewielka populacja węży z rodzaju Thamnophis z Oregonu, które posiadają wystarczająco dużo toksyn w swojej wątrobie od traszek, które jedzą, by być skutecznie trujące dla lokalnych małych drapieżników, takich jak wrony i lisy[41].
Jad węży jest mieszaniną białek i jest przechowywany w gruczołach jadowych znajdujących się z tyłu głowy[41]. U wszystkich jadowitych węży gruczoły te są otwarte/prowadzą do kanałów lub rowków w zębach w górnej szczęce[5][40]. Te białka potencjalnie mogą być mieszaniną neurotoksyn (które atakują układ nerwowy), hemotoksyn (które atakują układ krążenia), cytotoksyn, bungarotoksyn i wielu innych toksyn, które wpływają na organizm w różny sposób[40]. Jad niemal wszystkich węży zawiera hialuronidazę – enzym, który zapewnia szybkie rozprzestrzenienie się jadu[5].
Jadowite węże, których jad zawiera hemotoksyny mają zazwyczaj kły - za pomocą których wydzielają jad - umieszczone w przedniej części jamy gębowej, ułatwiając im wstrzykiwanie go do swoich ofiar[40]. Niektóre węże stosujące neurotoksyny, takie jak Boiga dendrophila, mają kły umiejscowione w tylnej części pyska, zakrzywione do tyłu[42]. To sprawia, że staje się trudne zarówno użycie jadu przez węże, jak i pobranie go przez naukowców[40]. Zdradnicowate, jednakże, tak jak kobry i niemrawce z rodzaju Bungarus posiadają typ uzębienia zwany proteroglypha (przodo-kłowe) – mają kanaliki w kłach, które nie mogą być wzniesione do przodu ich pyska i nie mogą one „kąsać” nimi tak jak żmije, ale muszą faktycznie ugryźć ofiarę[5].
Ostatnio zasugerowano, że wszystkie węże mogą być jadowite do pewnego stopnia, nieszkodliwe węże posiadają słaby jad i nie mają kłów[43]. Większość węży obecnie określane jako „niejadowite” nadal mogą być uznawane za nieszkodliwe według tej teorii, ponieważ albo nie wykształciły odpowiedniego sposobu dostawy jadu lub nie są w stanie dostarczyć tyle jadu, by zagrozić człowiekowi.
Teoria ta zakłada, że węże mogły ewoluować od wspólnego przodka - jadowitej jaszczurki, od której mogą pochodzić bezpośrednio takie współczesne jaszczurki, jak: heloderma arizońska (Heloderma suspectum), heloderma meksykańska (Heloderma horridum), warany, czy obecnie już wymarłe mozazaury. Występują one w hipotetycznym kladzie jadowitych łuskonośnych z wieloma innymi gatunkami z grupy Sauria.
Jadowite węże są klasyfikowane w dwóch taksonomicznych rodzinach:
- Elapidae – kobry wliczając kobrę królewską (Ophiophagus hannah), gatunki z rodzaju Bungarus, mamby, gatunki z rodzaju Austrelaps, węże morskie, gatunki z rodzajów Micrurus (koralówki), Calliophis, Leptomicrurus i Micruroides (tzw. węże koralowe)[42].
- Viperidae – żmije, grzechotniki i inne[42].
Istnieje trzecia rodzina zawierająca węże tylno-kłowe (typ uzębienia zwany opisthoglypha, jak również większość innych gatunków węży:
- Colubridae – niektóre połozy właściwe (m.in.: dysfolid (Dispholidus typus), gatunki z rodzaju Thelotornis), niektóre zaskrońce (m.in.: gatunki z rodzajów Rhabdophis, Thamnophis, Xenochrophis), czy niektóre gatunki z rodzajów: Ahaetulla i Boiga, chociaż nie wszystkie połozowate są jadowite[5][42].
Zmysły
Wzrok
Wzrok węży jest bardzo zróżnicowany, od jego braku w przypadku ślepych węży po ostry, ale główny trend pokazuje, że ich wzrok jest odpowiedni, chociaż nie ostry, pozwalając śledzić im ruchy[44]. Generalnie, wzrok jest najlepszy u węży nadrzewnych, a najsłabszy u węży podziemnych. Niektóre węże, na przykład z rodzaju Ahaetulla, mają zdolność widzenia obuocznego, umożliwiającą skupienie wzroku obydwoma oczami na jednym punkcie. Większość węży koncentruje wzrok przez ruch soczewek do przodu i do tyłu w stosunku do siatkówki, podczas gdy u innych grup owodniowców, soczewki są rozciągnięte.
Węch
Węże wykorzystują węch do tropienia swoich ofiar. Za pomocą rozwidlonego języka zbierane są cząsteczki powietrza, po czym zostają one przekazane w celu rozpoznania do narządu Jacobsona (narządu przylemieszowego) znajdującego się w jamie ustnej[45]. Rozszczepienie języka daje wężowi swego rodzaju kierunkowe poczucie zmysłu węchu i smaku jednocześnie[45]. Wąż utrzymuje swój język w ciągłym ruchu, pobierając próbki cząstek (stałych) z powietrza, ziemi i wody, analizując znalezione substancje chemiczne, tym samym rozpoznając obecność potencjalnych ofiar lub drapieżników w swoim lokalnym środowisku[45].
Wrażliwość na drgania
Część ciała, która jest w bezpośrednim kontakcie z powierzchnią ziemi jest bardzo wrażliwa na drgania, dlatego wąż jest w stanie wyczuwać inne zbliżające się zwierzęta poprzez wykrywanie nawet bardzo słabych wibracji w powietrzu i na ziemi[45].
Wrażliwość na podczerwień
Grzechotniki, pytony i niektóre gatunki boa mają receptory wrażliwe na podczerwień w głębokich bruzdach pomiędzy nozdrzem i okiem, chociaż niektóre mają wargowe rowki na górnej wardze tuż pod nozdrzami (powszechne u pytonów), które pozwalają im „widzieć” promieniowanie cieplne[45]. Podczerwień pomaga wężom zlokalizować pobliską zdobycz, zwłaszcza ciepłokrwiste ssaki.
Dieta
Wszystkie węże są całkowicie mięsożerne, żywiąc się małymi zwierzętami, w tym jaszczurkami, innymi wężami, małymi ssakami, ptakami, jajami, rybami, ślimakami lub owadami[5][6][46]. Ponieważ węże nie są w stanie rozgryźć, ani rozszarpać swojej zdobyczy na kawałki, muszą ją połknąć w całości. Rozmiar ciała węży ma znaczący wpływ na jego nawyki żywieniowe. Mniejsze węże jedzą mniejsze zwierzęta. Młode pytony mogą zacząć jeść jaszczurki lub myszy i stopniowo przejść na przykład do małych jeleni lub antylop, gdy staną się dorosłe.
Szczęki węży są najbardziej unikalnymi w całym królestwie zwierząt. W przeciwieństwie do popularnego poglądu, że mogą one przemieścić swoje szczęki, węże mają tzw. czaszkę kinetyczną, w której połączenie szczęk jest ruchome (kość kwadratowa), kości podniebienia rozsuwają się, a żuchwa składa się z dwóch połówek powiązanych więzadłem, dzięki czemu mogą otworzyć pysk tak szeroko, by móc połknąć swoją ofiarę w całości, nawet jeśli ma ona większą średnicę od samego węża[46], bez konieczności przeżuwania. Na przykład jajożer (Dasypeltis scabra) posiada elastyczne szczęki przystosowane do jedzenia jaj znacznie większych niż średnica jego głowy[5]. Wąż ten nie ma zębów, ale posiada kostne występy na wewnętrznej krawędzi jego kręgosłupa, przy pomocy których jest on zdolny do kruszenia skorupy jedzonego jaja[5].
Chociaż większość węży je różnorodne zwierzęta drapieżne, niektóre z nich wyspecjalizowały się w polowaniu na konkretne gatunki. Kobra królewska i australijski Vermicella annulata konsumują inne węże. Pareas iwesakii i inne żywiące się ślimakami gatunki z podrodziny Pareatinae mają więcej zębów po prawej stronie jamy gębowej niż po lewej, gdyż skorupy ślimaków, którymi się żywią są zwykle skręcone zgodnie z ruchem wskazówek zegara[5][47].
Niektóre gatunki mają trujący jad, którego używają by zabić swoją ofiarę przed zjedzeniem jej[46][48]. Inne węże zabijają przez duszenie[46]. Jeszcze inne połykają ofiary całe i żywe[5][46].
Po zjedzeniu, węże przechodzą w stan spoczynku i rozpoczyna się proces trawienia[49]. Trawienie jest intensywne, szczególnie po konsumpcji bardzo dużej ofiary. U gatunków, żywiących się tylko sporadycznie, całe jelito ulega zmniejszeniu pomiędzy posiłkami w celu zachowania energii. Układ pokarmowy jest następnie „regulowany” do pełnej pojemności w ciągu 48 godzin od konsumpcji.
Ponieważ węże są zimnokrwiste, temperatura otoczenia odgrywa u nich dużą rolę w procesie trawienia. 30 stopni Celsjusza jest idealną temperaturą do trawienia pokarmu przez węże. Podczas trawienia pochłaniana jest u węży tak duża ilość energii metabolicznej, że u grzechotnika straszliwego zaobserwowano wzrost temperatury ciała aż o 1,2 stopni Celsjusza w trakcie procesu trawienia[50]. Ze względu na to, zaniepokojony zaraz po zjedzeniu wąż często zwraca swoją zdobycz, aby mieć możliwość ucieczki przed dostrzeżonym zagrożeniem. Gdy spokój węża nie jest zakłócany, proces trawienia jest bardzo wydajny - enzymy trawienne rozpuszczają i pochłaniają wszystko, prócz włosów i pazurów, które są wydalane wraz z odchodami.
Rozmnażanie
Pomimo że u węży rozpoznano wiele sposobów rozmnażania, wszystkie węże wykształciły zapłodnienie wewnętrzne, które odbywa się za pomocą parzystych, rozwidlonych narządów rozrodczych (tzw. hemipenis), które przechowywane są odwrócone w ogonie samca[51]. Są one często żłobione rowkowane, haczykowate lub skręcone w celu chwycenia ścianek kloaki samicy[51].
Większość gatunków węży składa jaja i większość z tych gatunków opuszcza je krótko po złożeniu, jednakże niektóre gatunki, takie jak kobra królewska budują gniazda i przebywają w jego okolicy również po wykluciu się młodych[51]. Większość gatunków pytonów zwija się wokół swoich jaj po ich złożeniu i pozostaje z nimi aż do wyklucia[52]. Samice pytonów nie pozostawiają jaj, z wyjątkiem sporadycznego wygrzewania się w słońcu lub picia wody. Wytwarzają one ciepło do inkubacji jaj poprzez drżenie[52].
Niektóre gatunki węży są jajożyworodne i przechowują jaja w swoich ciałach, dopóki nie są one prawie gotowe do wyklucia[53][54]. Niedawne badania potwierdziły, że kilka gatunków węży jest w pełni żyworodnych, takich jak boa dusiciel i anakonda zielona, karmiąc swoje młode poprzez łożysko, czy pęcherzyk żółtkowy, co jest bardzo nietypowe wśród gadów oraz i u innych grup zwierząt z wyjątkiem ssaków łożyskowych[53][54]. Jajożyworodność jest najczęściej związana z chłodniejszym środowiskiem, tak samo jak pozostawanie młodych po wykluciu przy samicy[51][54].
Interakcje z ludźmi
Ugryzienie węża
Węże nie polują zazwyczaj na ludzi i większość z nich nie atakuje ludzi, a nawet unika z nimi kontaktu, chyba że zostanie zaskoczony, zaatakowany lub zraniony. Z wyjątkiem dużych dusicieli, niejadowite węże nie stanowią zagrożenia dla ludzi. Ugryzienie niejadowitych węży jest zwykle nieszkodliwe, ponieważ ich zęby są przeznaczone do chwytania i trzymania, a rzadziej do szarpania, czy powodowania głęboko kłutych ran. Chociaż istnieje możliwość zakażenia i uszkodzenia tkanek przez ugryzienie niejadowitego węża, jadowite węże stanowią znacznie większe zagrożenie dla ludzi[5].
Udokumentowane zgony będące następstwem ugryzienia węży niejadowitych są rzadkie. Ugryzienia węży jadowitych, jeśli nie okaże się śmiertelne, może spowodować konieczność amputacji całej kończyny lub jej części. Spośród około 725 gatunków węży jadowitych żyjących na Ziemi, tylko 250 jest w stanie zabić człowieka jednym ugryzieniem. W Australii średnio w roku tylko jedna osoba zostaje ugryziona. W Indiach w ciągu roku rejestrowanych jest 250 000 ukąszeń, z czego aż 50 000 kończy się śmiercią[55].
Leczenie ukąszenia węża jest tak różne, jak samo ukąszenie. Najbardziej rozpowszechnioną i skuteczną metodą jest podanie antytoksyny (surowicy) wykonanej z jadu węża. Niektóre antytoksyny są charakterystyczne dla danego gatunku, podczas gdy niektóre/inne [z nich] mogą być użyte w przypadku ukąszenia wielu gatunków. Przykładowo w Stanach Zjednoczonych wszystkie gatunki węży jadowitych należą do podrodziny grzechotnikowatych, z wyjątkiem węży koralowych zaliczanych do rodziny zdradnicowatych. Do produkcji surowicy, mieszanka jadów różnych gatunków grzechotników wstrzykiwana jest do ciała konia w coraz większych dawkach do momentu, gdy koń się niego uodporni. Następnie z uodpornionego konia pobiera się krew, oddziela serum, oczyszcza je i poddaje liofilizacji. W ostatnim etapie jest rozcieńczane z jałową wodą i staje się surowicą. Z tego powodu ludzie, którzy mają alergię na konie są bardziej podatni na alergię na tak sporządzoną surowicę[56]. Surowica na jad bardziej niebezpiecznych gatunków (takich grup jak mamby, tajpany, czy i kobry) jest robiona w podobny sposób w Indiach, Afryce Południowej i Australii, choć te surowice są charakterystyczne dla danego gatunku.
Zaklinanie węży
W niektórych częściach świata, zwłaszcza w Indiach, zaklinanie węży jest przydrożnym spektaklem odgrywanym przez zaklinacza.
W takim pokazie, zaklinacz posiada kosz, w którym znajduje się wąż, którego pozornie zaklina wygrywając melodie ze swojego fletopodobnego instrumentu muzycznego, na które wąż odpowiada[57]. Węże nie posiadają uszu zewnętrznych i choć mają uszy wewnętrzne, reagują na ruch fletu, a nie na dźwięk muzyki[57][58].
Indyjskie Prawo Ochrony Przyrody z 1972 r. zabrania zaklinania węży ze względu na okrucieństwo wobec zwierząt. Inni zaklinacze węży prezentują także pokazy z wężami i mangustami, gdzie zwierzęta te pozornie ze sobą walczą; jakkolwiek nie są to częste przypadki - zarówno węże, jak i mangusty, mogą poważnie ucierpieć lub nawet zostać zabite. Zaklinanie węży jest w Indiach wymierającą profesją z powodu konkurencji współczesnych form rozrywki i praw ochrony środowiska zakazujących tej praktyki[57].
Odłów węży
Członkowie plemienia „Irulas” ze stanów Andhra Pradesh i Tamil Nadu w Indiach wyspecjalizowali się w polowaniach na węże w gorących, suchych lasach równinnych i praktykowali tę sztukę od pokoleń. Mają obszerną wiedzę w dziedzinie węży. Zazwyczaj łapią je za pomocą prostego kija. Wcześniej, plemiona te odławiały węże na potrzeby przemysłu skór. Po całkowitym zakazie nałożonym na ten przemysł w Indiach i nałożeniu ochrony wszystkich węży w Indyjskim Akcie Ochrony Przyrody z 1972 r., utworzyli oni rodzaj stowarzyszenia i wykorzystując doświadczenie odławiają węże w celu pobierania ich jadu, by następnie uwalniać je na łono natury/wolność po pobraniu czterech porcji jadu. Zebrany w ten sposób jad jest wykorzystywany do produkcji ratującej życie surowicy, innych produktów medycznych czy do badań biomedycznych[59]. Plemię „Irulas” znane jest również z jedzenia niektórych węży, które złapią oraz jest bardzo przydatne w tępieniu szczurów w indyjskich wioskach.
Oprócz zaklinaczy węży, istnieją również profesjonalni łapacze węży. Współcześnie do odłowu węży angażuje się herpetologów używających długich lasek zakończonych w kształcie litery „V”. Niektórzy z gospodarzy programów telewizyjnych, jak Bill Haast, Steve Irwin, Jeff Corwin, czy Austin Stevens preferują chwytanie węży gołymi rękami.
Konsumpcja węży
Choć przez większość kultur nie uważana powszechnie za pozycję kulinarną, w niektórych z nich, konsumpcja węży jest akceptowalna, a nawet uważane są one za przysmak, ceniony między innymi za swoje domniemane farmaceutyczne możliwości ogrzewania serca. W kuchni kantońskiej zupa z węża jest spożywana przez lokalnych mieszkańców jesienią, na rozgrzanie ciała. Zachodnie cywilizacje dokumentują konsumpcję węży w ekstremalnych przypadkach głodu[60]. Gotowane mięso grzechotnika stanowi wyjątek i jest powszechnie spożywane w środkowozachodnich stanach USA. W krajach azjatyckich, takich jak Chiny, Tajwan, Tajlandia, Indonezja, Wietnam i Kambodża uważa się, że picie krwi węży - w szczególności kobry - powoduje wzrost potencji seksualnej[61]. Krew jest spuszczana, kiedy kobra jest wciąż żywa - jeśli to możliwe i zwykle jest mieszana z jakąś formą trunku w celu poprawy smaku[61].
W niektórych krajach azjatyckich, wykorzystanie węży w alkoholu jest również akceptowalne. W takich przypadkach, całe ciało jednego lub kilku węży pozostawia się zanurzone w słoiku (lub innym naczyniu) z alkoholem. Ma to uczynić alkohol mocniejszym (jak również droższym). Jednym z tego przykładów jest wąż z gatunku Trimeresurus flavoviridis (zwany również „habu”) umieszczany niekiedy w napoju alkoholowym z japońskiej prefektury Okinawa – Awamori, znanym również jako „Habu Sake”[62].
Wino z węży (蛇 酒) to napój alkoholowy produkowany przez zaparzanie całego węża w winie ryżowym lub alkoholu zbożowym. Po raz pierwszy napój ten odnotowano w Chinach podczas panowania Zachodniej Dynastii Zhou i był uważany za ważny środek leczniczy, a według tradycyjnej medycyny chińskiej miał moc ożywienia człowieka[63].
Praktykanci amerykańskich Zielonych Beretów uczą się łapać, zabijać i jeść węże podczas kursów survivalowych; przez ten zwyczaj nadano im przydomek „zjadaczy węży”, od którego - jak można przypuszczać - wzięła się nazwa gry wideo „Metal Gear Solid 3: Snake Eater”.
Węże jako zwierzęta domowe
W krajach zachodnich niektóre węże, szczególnie łagodne gatunki, takie jak pyton królewski (Python regius), czy wąż zbożowy (Elaphe guttata) trzymane są jako zwierzęta domowe. W celu zaspokojenia popytu rozwinął się przemysł hodowli węży. Węże wychowane w niewoli są uważane za mniej agresywne, niż osobniki złapane na wolności[64]. Węże mogą być bardzo tanimi w utrzymaniu zwierzętami domowymi, zwłaszcza w porównaniu do bardziej tradycyjnych gatunków. Wymagają one minimalnej przestrzeni, bowiem większość popularnych gatunków nie przekracza 1,5 metra długości. Węże hodowane w domu mogą być karmione stosunkowo rzadko, zwykle raz na pięć do czternastu dni. Niektóre gatunki węży dożywają w odpowiednich warunkach ponad czterdziestu lat.
W kulturze
Egipt
W historii Egiptu wąż zajmował szczególne miejsce z kobrą nilową zdobiącą koronę faraona w czasach starożytnych. Był czczony jako jedno z bóstw i był także wykorzystywany do złowrogich celów: zabójstwa oponenta i rytualnego samobójstwa (Kleopatra VII).
Mitologia grecko-rzymska
W mitologii greckiej węże są często związane z zabójczymi i niebezpiecznymi przeciwnikami, ale to nie znaczy, że węże są symbolem zła; w istocie, węże są symbolem bóstw chtonicznych, w przybliżeniu tłumaczonymi jako „związane z ziemią”. Dziewięciogłowa Hydra lernejska, którą pokonał Herakles i trzy Gorgony są dziećmi Gai, Matki-Ziemi[65]. Jedna z Gorgon - Meduza, którą pokonał Perseusz, opisywana jest jako odrażające stworzenie z wężami zamiast włosów i mocą przemieniania mężczyzn w kamień spojrzeniem[65]. Po jej zabiciu Perseusz oddał jej głowę Atenie, która przymocowała ją do swojej tarczy zwanej Egidą[65]. Tytani są także przedstawiani w sztuce z wężami zamiast nóg i stóp z tego samego powodu - są dziećmi Gai i Uranosa, a więc są oni związani z ziemią.
Postać węża wiązała się też z kultem Asklepiosa-Eskulapa, a także Serapisa i Glykona.
Legendarny przekaz o założeniu Teb wspomina potwornego węża strzegącego źródła, z którego nowa osada miała pobierać wodę. W walce i zabiciu węża, wszyscy towarzysze założyciela Teb - Kadmosa - zginęli, co dało początek powiedzeniu „kadmosowe zwycięstwo”, czyli zwycięstwo okupione własną zagładą.
Trzy symbole medyczne związane z wężami, będące nadal w powszechnym użyciu to: Kielich Higiei, symbolizujący farmację, kaduceusz (kerykejon) – znak pokoju i handlu oraz Laska Eskulapa – symbol medycyny[38].
Tradycja judeochrześcijańska
Wykonany przez Mojżesza na polecenie Boga miedziany wąż (Lb 21, 8–9) był czczony w Świątyni Jerozolimskiej do czasu, gdy został zniszczony przez króla Ezechiasza (2Krl 18,4). Według jednego z midraszy, Jahwe napadając na Mojżesza w miejscu noclegu na pustyni (Wj 4, 24) przybrał postać wielkiego węża i połknął go aż do połowy[66]. W wielu tekstach Starego Testamentu wąż jawi się jako zwierzę przebiegłe, symbol zła, pokusy (Rdz 3, 1-3). Dopiero Księga Mądrości, pisana po grecku w I w. p.n.e., utożsamia go być może z Szatanem (por. Mdr 2,24)[67].
Indie
Indie są często nazywane krainą węży i są bogate w tradycje związane z wężami[68]. Węże są czczone jako bogowie nawet dziś i wiele kobiet polewa mlekiem jamy węży (pomimo że węże mają awersję do mleka)[68]. Kobra widoczna na szyi jednych z najważniejszych bóstw (dewów) hinduizmu - Śiwy i Wisznu jest często przedstawiana jako śpiąca na siedmiogłowym wężu lub wewnątrz zwiniętego węża[69]. W Indiach istnieje również kilka świątyń poświęconych wyłącznie kobrom, zwanych niekiedy „Nagraj"” (Król Węży) i wierzono, że węże są symbolami płodności. Istnieje hinduskie doroczne święto „Nagapańćami”, podczas którego czci się węże i modli do nich.
.
W Indiach istnieje jeszcze inna mitologia o wężach. Węże, powszechnie znane w Hindi jako „Ichchhadhari”, mogą mieć formę jakiejkolwiek żywej istoty, najczęściej jednak ludzką. Te mityczne węże posiadają cenny klejnot zwany „Mani”, który jest bardziej lśniący niż diament. Istnieje wiele opowieści w Indiach o chciwych ludziach, którzy starają się posiąść ten klejnot i ostatecznie w ten sposób giną.
Uroboros jest symbolem związanym z wieloma różnymi religiami i obrzędami, uważany jest też jako symbol mający związki alchemią. Uroboros (lub urobor) jest przedstawiany jest jako wąż jedzący swój własny ogon, najczęściej w kierunku zgodnym z ruchem wskazówek zegara (od głowy do ogona) w kształcie okręgu, reprezentując cykl życia, śmierci i odrodzenia prowadzącego do nieśmiertelności.
Chiny
Wąż jest jednym z 12 niebianskich zwierząt zodiaku chińskiego w kalendarzu chińskim.
Peru
Wiele starożytnych peruwiańskich kultur oddawało cześć naturze[70]. Większą rolę przypisywali zwierzętom i często przedstawiali węże w swojej sztuce[71].
Przypisy
- ↑ a b c d e f g h Serpentes, [w:] Integrated Taxonomic Information System [online] (ang.).
- ↑ THE TIGR REPTILE DATABASE. [dostęp 2009-07-04]. (ang.).
- ↑ Petr Vlček, Bartłomiej Najbar, Daniel Jablonski. First records of the Dice Snake (Natrix tessellata) from the North-Eastern part of the Czech Republic and Poland. „Herpetology Notes”. 3, s. 23–26, 2010. (ang.).
- ↑ Michael W. Caldwell, Randall L. Nydam, Alessandro Palci i Sebastián Apesteguía. The oldest known snakes from the Middle Jurassic-Lower Cretaceous provide insights on snake evolution. „Nature Communications”. 6, s. Artykuł nr 5996, 2015. DOI: 10.1038/ncomms6996.
- ↑ a b c d e f g h i j k l m n o p q r Mehrtens JM. 1987. Living Snakes of the World in Color. New York: Sterling Publishers. 480 pp. ISBN 0-8069-6460-X.
- ↑ a b c d e Alejandro Sanchez: Diapsids III: Snakes. [w:] Father Sanchez's Web Site of West Indian Natural History [on-line]. [dostęp 2008-01-08].
- ↑ a b Mc Dowell, Samuel (1972), „The evolution of the tongue of snakes and its bearing on snake origins”, Evolutionary Biology 6: 191–273
- ↑ Sebastián Apesteguía, Hussam Zaher. A Cretaceous terrestrial snake with robust hindlimbs and a sacrum. „Nature”. 440 (7087), s. 1037–1040, 2006. DOI: 10.1038/nature04413.
- ↑ a b c Mertens, Robert (1961), „Lanthanotus: an important lizard in evolution”, Sarawak Museum Journal 10: 320–322
- ↑ a b New Fossil Snake With Legs”. UNEP WCMC Database. Washington, D.C.: American Association For The Advancement Of Science.
- ↑ Desirée A. Douglas, Axel Janke, Ulfur Arnason. A mitogenomic study on the phylogenetic position of snakes. „Zoologica Scripta”. 35 (6), s. 545–558, 2006. DOI: 10.1111/j.1463-6409.2006.00257.x. (ang.).
- ↑ Jack L. Conrad. Phylogeny and systematics of Squamata (Reptilia) based on morphology. „Bulletin of the American Museum of Natural History”. 310, s. 1–182, 2008. DOI: 10.1206/310.1. (ang.).
- ↑ Jacques A. Gauthier, Maureen Kearney, Jessica Anderson Maisano, Olivier Rieppel, Adam D.B. Behlke. Assembling the squamate tree of life: perspectives from the phenotype and the fossil record. „Bulletin of the Peabody Museum of Natural History”. 53 (1), s. 3–308, 2012. DOI: 10.3374/014.053.0101. (ang.).
- ↑ John J. Wiens, Carl R. Hutter, Daniel G. Mulcahy, Brice P. Noonan, Ted M. Townsend, Jack W. Sites Jr., Tod W. Reeder. Resolving the phylogeny of lizards and snakes (Squamata) with extensive sampling of genes and species. „Biology Letters”. 8 (6), s. 1043–1046, 2012. DOI: 10.1098/rsbl.2012.0703. (ang.).
- ↑ Robert Alexander Pyron, Frank T. Burbrink, John J. Wiens. A phylogeny and revised classification of Squamata, including 4161 species of lizards and snakes. „BMC Evolutionary Biology”. 13: 93, 2013. DOI: 10.1186/1471-2148-13-93. (ang.).
- ↑ a b Conant R, Collins JT. 1991. A Field Guide to Reptiles and Amphibians: Eastern and Central North America. Houghton Mifflin, Boston. 450 pp. 48 plates. ISBN 0-395-37022-1.
- ↑ Natural history questions and answers - Collections and Library - Auckland War Memorial Museum, [w:] Auckland War Memorial Museum | Tamaki Paenga Hira [online], Auckland War Memorial Museum [dostęp 2013-08-26] [zarchiwizowane z adresu 2013-09-30] (ang.).
- ↑ Pough et al. 1992. Herpetology: Third Edition. Pearson Prentice Hall:Pearson Education, Inc., 2002.
- ↑ Jeffrey A. Wilson, Dhananjay M. Mohabey, Shanan E. Peters, Jason J. Head. Predation upon Hatchling Dinosaurs by a New Snake from the Late Cretaceous of India. „PLoS Biology”. 8 (3), s. e1000322, 2010. DOI: 10.1371/journal.pbio.1000322. (ang.).
- ↑ R. Lawson i inni, Phylogeny of the Colubroidea (Serpentes): New evidence from mitochondrial and nuclear genes, „Molecular Phylogenetics and Evolution”, 37 (2), 2005, s. 581–601, DOI: 10.1016/j.ympev.2005.07.016.
- ↑ Nicolas Vidal i inni, The phylogeny and classification of caenophidian snakes inferred from seven nuclear protein-coding genes, „Comptes Rendus Biologies”, 330 (2), 2007, s. 182–187, DOI: 10.1016/j.crvi.2006.10.001.
- ↑ Christopher M.R. Kelly i inni, Phylogeny, biogeography and classification of the snake superfamily Elapoidea: a rapid radiation in the late Eocene, „Cladistics”, 25 (1), 2009, s. 38–63, DOI: 10.1111/j.1096-0031.2008.00237.x, ISSN 1096-0031 (ang.).
- ↑ Hussam Zaher, Felipe Gobbi Grazziotin, John E. Cadle, Robert W. Murphy, Julio Cesar de Moura-Leite i Sandro L. Bonatto (2009) „Molecular phylogeny of advanced snakes (Serpentes, Caenophidia) with an emphasis on South American Xenodontines: A revised classification and descriptions of new taxa.” Papéis Avulsos de Zoologia 49(11):115-153.
- ↑ Thomas P. Wilcox, Derrick J. Zwickl, Tracy A. Heath, i David M. Hillis (2002) „Phylogenetic relationships of the dwarf boas and a comparison of Bayesian and bootstrap measures of phylogenetic support” Molecular Phylogenetics and Evolution 25: 361-371.
- ↑ Joseph B. Slowinski i Robin Lawson (2002) „Snake phylogeny: evidence from nuclear and mitochondrial genes” Molecular Phylogenetics and Evolution 24: 194–202.
- ↑ Nicolas Vidal, Anne-Sophie Delmas i S. Blair Hedges: „The higher-level relationships of alethinophidian snakes inferred from seven nuclear and mitochondrial genes”. W: R.W. Henderson, R. Powell (red.) Biology of the Boas and Pythons. Eagle Montain, Utah: Eagle Mountain Publishing, 2007, ss. 27-33.
- ↑ Hussam Zaher (1994) „Les Tropidopheoidea (Serpentes; Alethinophidia) sont-ils réellement monophylétiques? Arguments en faveur de leur polyphylétisme” Comptes rendus de l'Académie des sciences. Série 3, Sciences de la vie 317: 471-478.
- ↑ a b McDiarmid RW, Campbell JA, Touré T. 1999. Snake Species of the World: A Taxonomic and Geographic Reference, vol. 1. Herpetologists' League. 511 pp. ISBN 1-893777-00-6 (series). ISBN 1-893777-01-4 (volume).
- ↑ Spawls S, Branch B. 1995. The Dangerous Snakes of Africa. Ralph Curtis Books. Dubai: Oriental Press. 192 pp. ISBN 0-88359-029-8.
- ↑ Parker HW, Grandison AGC. 1977. Snakes -- a natural history. Second Edition. British Museum (Natural History) and Cornell University Press. 108 pp. 16 plates. LCCCN 76-54625. ISBN 0-8014-1095-9 (cloth), ISBN 0-8014-9164-9 (paper).
- ↑ Spawls S, Howell K, Drewes R, Ashe J. 2004. A Field Guide To The Reptiles Of East Africa. London: A & C Black Publishers Ltd. 543 pp. ISBN 0-7136-6817-2.
- ↑ Elapidae at the TIGR Reptile Database. Accessed 3 December 2008.
- ↑ Od angielskiego zwrotu keeled scales (keel - „stępka”, „kil”; scales - „łuski”).
- ↑ Smith, Malcolm A. Fauna of British India...Vol I - Loricata and Testudines, page 30
- ↑ a b c d Are snakes slimy? at Singapore Zoological Garden's Docent. Accessed 14 August 2006.
- ↑ Part III: Scales of Lizards and Snakes at WhoZoo. Accessed 4 December 2008.
- ↑ a b General Snake Information at South Dakota Game, Fish and Parks. Accessed 4 December 2008.
- ↑ a b Wilcox RA., Whitham EM. The symbol of modern medicine: why one snake is more than two.. „Annals of internal medicine”. 8 (138), s. 673–7, kwiecień 2003. PMID: 12693891.
- ↑ a b c d e f Mader, Douglas (June 1995), „Reptilian Anatomy”, Reptiles 3 (2): 84–93
- ↑ a b c d e Freiberg (1984), p.125
- ↑ a b Freiberg (1984), p.123
- ↑ a b c d Freiberg (1984), pp.126
- ↑ Fry BG., Vidal N., Norman JA., Vonk FJ., Scheib H., Ramjan SF., Kuruppu S., Fung K., Hedges SB., Richardson MK., Hodgson WC., Ignjatovic V., Summerhayes R., Kochva E. Early evolution of the venom system in lizards and snakes.. „Nature”. 7076 (439), s. 584–8, luty 2006. DOI: 10.1038/nature04328. PMID: 16292255.
- ↑ Reptile Senses: Understanding Their World.
- ↑ a b c d e Cogger(1991), p.180
- ↑ a b c d e Behler (1979) p.581
- ↑ Hoso M., Asami T., Hori M. Right-handed snakes: convergent evolution of asymmetry for functional specialization.. „Biology letters”. 2 (3), s. 169–72, kwiecień 2007. DOI: 10.1098/rsbl.2006.0600. PMID: 17307721.
- ↑ Freiberg (1984), pp.125–127
- ↑ Rosenfeld(1989), p.11
- ↑ Tattersall GJ., Milsom WK., Abe AS., Brito SP., Andrade DV. The thermogenesis of digestion in rattlesnakes.. „The Journal of experimental biology”. Pt 4 (207), s. 579–85, luty 2004. PMID: 14718501..
- ↑ a b c d Capula (1989), p.117
- ↑ a b Cogger (1991), p.186
- ↑ a b Capula (1989), p.118
- ↑ a b c Cogger (1991), p.182
- ↑ Kounteya Sinha: No more the land of snake charmers.... The Times of India, 25.07.2006. [dostęp 2013-10-09]. (ang.).
- ↑ I. Dubinsky. Rattlesnake bite in a patient with horse allergy and von Willebrand's disease: case report.. „Can Fam Physician”. 42, s. 2207-11, Nov 1996. PMID: 8939322. (ang.).
- ↑ a b c Bagla, Pallava (April 23, 2002). „India's Snake Charmers Fade, Blaming Eco-Laws, TV”, National Geographic News. Retrieved on 26 November 2007.
- ↑ International Wildlife encyclopedia, 3rd edition, p. 482
- ↑ Whitaker, Romulus & Captain, Ashok. Snakes of India: The Field Guide.(2004) pp 11 to 13.
- ↑ Irvine, F.R. 1954. Snakes as food for man. British Journal of Herpetology. 1(10):183–189.
- ↑ a b Flynn, Eugene (April 23, 2002). „Flynn Of The Orient Meets The Cobra”, Fabulous Travel. Retrieved on 26 November 2007.
- ↑ Allen, David (July 22, 2001). „Okinawa’s potent habu sake packs healthy punch, poisonous snake”, Stars and Stripes. Retrieved on 26 November 2007.
- ↑ "蛇酒的泡制与药用(Produkcja i właściwości lecznicze wina z węży). cn939.com. [zarchiwizowane z tego adresu (2011-07-06)]. (zh)
- ↑ Ernst, Carl; George R. Zug, Molly Dwyer Griffin (1996). Snakes in Question: The Smithsonian Answer Book. Washington, DC: Smithsonian Books. pp. 203. ISBN 1-56098-648-4.
- ↑ a b c Bullfinch (2000) p. 85
- ↑ Stworzenie świata według innych tekstów biblijnych. W: Robert Graves, Raphael Patai: Mity hebrajskie. Wyd. pierwsze. Warszawa: Cyklady, 1993, s. 30. ISBN 83-900592-1-5.
- ↑ Anna Świderkówna, Rozmowy o Biblii
- ↑ a b Deane (1833). p.61
- ↑ Deane (1833). p.62–64
- ↑ Benson, Elizabeth, The Mochica: A Culture of Peru. New York, NY: Praeger Press. 1972
- ↑ Berrin, Katherine & Larco Museum. The Spirit of Ancient Peru: Treasures from the Museo Arqueológico Rafael Larco Herrera. New York: Thames and Hudson, 1997.
Bibliografia
- W. Jaroniewski: Gady jadowite. PZWS. Warszawa 1969
- J. Maris.: Wielka księga węży. WK Twój Styl. Warszawa 1997
- Z. Szyndlar: Nieznane węże jadowite. Kosmos 3: 259-269. 1981.
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
| Maria Sibylla Merian
(1647–1717) |
|||
|---|---|---|---|
 |
|||
| Inne nazwiska i pseudonimy | Maria Sibylla Graff | ||
| Opis | niemiecka malarka, rysowniczka, akwarelistka, graficzka, pisarka i ilustratorka | ||
| Data urodzenia/śmierci |
2 kwietnia 1647 |
13 stycznia 1717 | |
| Miejsce urodzenia/śmierci | Frankfurt nad Menem | Amsterdam | |
| Okres działalności | od 1670 do 1717 | ||
| Miejsce działalności | Norymberga (1670-1685), Frankfurt nad Menem (1685), Fryzja (około 1685-1695), Amsterdam (1695-1717), Surinam (1699-1701) | ||
| Kontrola autorytatywna | |||
(c) Smacdonald z angielskiej Wikipedii, CC BY-SA 3.0
A captive Arafura file snake (Acrochordus arafurae).
Autor: User:Sarefo, Licencja: CC BY 2.5
World distribution of snakes (Order Serpentes), after data from Cogger, H.G & Zweifel, R.G. (1998). Reptiles & Amphibians". ISBN 0121785602 - black is land with snakes, blue sea with snakes. grey is land without, white water without.
Autor:
- Messelophis_ermannorum_01.jpg: Bjoertvedt
- derivative work: Kevmin (talk)
extinct pygmy boa Rieppelophis ermannorum from the Messel fossil site in Germany, on display at the Oslo Zoological Museum
Autor: photo taken by Artur Mikołajewski, Licencja: CC-BY-SA-3.0
Crossed Viper (Vipera berus), Bieszczady, Poland
(c) Mokele z angielskiej Wikipedii, CC BY-SA 3.0
My pet ball python - normal phase, probably an import (rescue)
Autor: AllenMcC., Licencja: CC BY-SA 3.0
King Brown aka Mulga Snake (Pseudechis australis)
Xenopeltis unicolor
Autor: W.A. Djatmiko (Wie146), Licencja: CC-BY-SA-3.0
Cylindrophis ruffus from Darmaga, Bogor, Java, Indonesia
Autor: משתמש:שועל, Licencja: GFDL
Atractaspis engaddensis in Haifa zoo terrarium
Autor: Jacek Proszyk, Licencja: CC BY-SA 4.0
Żmija zygzakowata
Autor: Jjargoud, Licencja: CC BY-SA 3.0
Round Island Boa (Casarea dussumieri), north of Mauritius
Autor: Photographer: LA Dawson, Licencja: CC BY-SA 2.5
Leptotyphlops dulcis

























