Walinomycyna
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C54H90N6O18 | ||||||||||||||||||||||||||||||||||||||||
| Masa molowa | 1111,32 g/mol | ||||||||||||||||||||||||||||||||||||||||
| Wygląd | beżowy krystaliczny proszek | ||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||
| Numer CAS | 2001-95-8 | ||||||||||||||||||||||||||||||||||||||||
| PubChem | 5649 | ||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||
| Podobne związki | enniatyny | ||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||
Walinomycyna – organiczny związek chemiczny pochodzenia naturalnego, cykliczny oligopeptyd z grupy depsypeptydów, antybiotyk z grupy streptogramin B. Jest jonoforem o wysokiej selektywności wiązania kationu potasu K+, który może być transportowany w postaci kompleksu przez błony komórkowe[1]. Proces ten obniża naturalny potencjał elektrochemiczny komórki. Ze względu na bardzo wysoką toksyczność związek ten nie jest stosowany w leczeniu ludzi ani zwierząt. Walinomycyna powstaje naturalnie w procesach metabolicznych bakterii Streptomyces fulvissimus[2], a także innych promieniowców z rodzaju Streptomyces (patogennych dla człowieka), np. S. tsusimaensis. Dowiedziono również, że walinomycyna produkowana jest przez paciorkowca kałowego – bakterie z rodzaju Enterococcus[3]. Biosynteza walinomycyny przez te mikroorganizmy została dokładnie przebadana i wyjaśniona[4][5]. Badania nad tym związkiem przyczyniły się do poznania mechanizmu działania jonoforów[6].
Historia
Walinomycyna jest jednym z najdokładniej przebadanych antybiotyków jonoforowych. Wyizolowana została po raz pierwszy w 1955 roku ze szczepu Streptomyces fulvissimus[2]. Berton Pressman zaobserwował udział walinomycyny w transporcie jonów przez błony biologiczne[7]. W 1964 roku Pressman wraz z Cyrilem Moore'em wykazali, że działanie walinomycyny jest silnie związane z obecnością kationów potasu[8]. Wykazali oni, że walinomycyna rozprzęga procesy fosforylacji oksydacyjnej w obecności kationów potasu i rubidu, lecz nie w obecności kationów sodu[9][10][11]. Pressman wysnuł hipotezę, że walinomycyna wpływa na działanie pompy sodowo-potasowej – jedynego znanego w tamtych czasach sposobu transportu jonów przez błony[12]. Trzy lata później, w 1967 roku Pressman wykazał, że walinomycyna tworzy związki kompleksowe z kationami potasu i może transportować te jony przez błony komórkowe samodzielnie. To przełomowe odkrycie uznawane jest za początek chemii jonoforów[6].
Struktura cząsteczki
Walinomycyna należy do grupy cyklodepsypeptydów, czyli związków makrocyklicznych zawierających zarówno wiązania peptydowe, jak i estrowymi. Cząsteczka walinomycyny składa się z trzech powtarzających się fragmentów zbudowanych z reszt kwasu L-mlekowego, L-waliny, kwasu D-2-hydroksyizowalerianowego i D-waliny połączonych w pierścień[1]. Łącznie w cząsteczce walinomycyny znajduje się 12 grup karbonylowych (6 amidowych i 6 estrowych).
Makrocykliczny pierścień tego depsypeptydu składa się z 36 atomów, a jego średnica w układzie płaskim jest o wiele za duża, aby kompleksować we wnętrzu kation potasu. Cząsteczka walinomycyny nie jest sztywna, lecz może ulegać znacznym zmianom konformacyjnym. Analiza rentgenowska wykazała, że walinomycyna może krystalizować w różnych układach krystalograficznych (trójskośnym, jednoskośnym i rombowym) i może różnić się układem wiązań wodorowych w zależności od użytego do krystalizacji rozpuszczalnika. Ponadto w hydrofilowej wnęce walinomycyny mogą być związane wodorowo cząsteczki wody[13][14][15].
Kompleksy
Kompleks z kationem potasu
Badania rentgenostrukturalne kompleksu walinomycyny z kationem potasu pokazały, że struktura ligandu w kompleksie zmienia się znacząco w porównaniu do struktury samego ligandu[16][17]. Proces kompleksowania kationu potasu wymusza zasadnicze zmiany konformacyjne oraz zmiany w układzie wiązań wodorowych. Walinomycyna przyjmuje tzw. „konformację piłki tenisowej” owijając się wokół kationu. Kation potasu koordynowany jest w tym kompleksie przez sześć atomów tlenu walinomycyny pochodzących od grup karbonylowych waliny, natomiast wszystkie amidowe atomy wodoru biorą udział w tworzeniu wewnątrzcząsteczkowych wiązań wodorowych. Kation potasu jest zamknięty w hydrofilowej wnęce wewnątrz cząsteczki, natomiast grupy alkilowe (izopropylowe i metylowe) skierowane są na zewnątrz cząsteczki tworząc tzw. hydrofobową sferę zewnętrzną. Taki kształt cząsteczki kompleksu sprawia, że jest on rozpuszczalny w rozpuszczalnikach niepolarnych oraz w błonach lipidowych.
Kompleksy z innymi kationami
Badania kompleksów z innymi kationami, np. z kationem sodu i rubidu przyczyniły się do wysunięcia teorii, że proces kompleksowania kationu potasu przez cząsteczkę walinomycyny jest związany ze stopniowym zrywaniem wiązań wodorowych pomiędzy ligandem a cząsteczkami wody[17][18]. W miejsce zerwanych wiązań wodorowych pojawiają się nowe wiązania koordynacyjne wiążące kation potasu. Cząsteczki wody mogą jednak wchodzić w sferę koordynacyjną kationu.
Przeprowadzone symulacje komputerowe dynamiki molekularnej (MD) sugerują natomiast, że szybkość procesu dekompleksowania kationu nie jest związana z tworzeniem się pośredniego adduktu z wodą, jak sugerował Pressman[7], lecz z właściwym ułożeniem cząsteczek kompleksu na granicy błony[19].
Stała trwałości kompleksu walinomycyny z kationem potasu jest 10 000 razy wyższa niż z kationem sodu[20][21]. Selektywność kompleksowania kationów jednowartościowych przez walinomycyny jest następująca[7][21]: Rb+ > K+ > Cs+ > Ag+ > NH+4 > Na+ > Li+.
Walinomycyna kompleksuje kationy metali drugiej grupy układu okresowego ze wzrastająca selektywnością[7]: Ba2+ > Ca2+ > Sr2+ > Mg2+.
Najnowsze badania pokazują, że jonofor ten tworzy kompleksy z dwuwartościowymi kationami metali przejściowych takimi jak[22][23]: Cu2+, Zn2+, Cd2+, Pb2+, UO2+2, Fe2+, Co2+ i Ni2+.
Obliczone stałe trwałości dla niektórych kompleksów maleją w szeregu[23]: Pb2+ > Cu2+ > UO2+2, Zn2+ > Ni2+ > Co2+, Cd2+ > Fe2+.
Mechanizm działania antybiotycznego
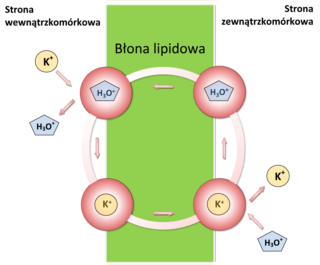
Wyjaśnienie mechanizmu kompleksowania kationu potasu przez walinomycynę było niezbędne do zrozumienia procesu transportu tego kationu przez błonę wewnętrzną mitochondrium i wpływu na proces fosforylacji oksydacyjnej. Mechanizm działania antybiotycznego walinomycyny wynika bowiem z selektywnego transportu kationów potasu przez błonę lipidową z macierzy mitochondrialnej do przestrzeni międzybłonowej tego organellum. Transport ten zakłóca naturalny gradient stężenia kationów K+ po obu stronach błony powodując zaburzenia procesów energetycznych komórki. Początkowo wydawało się, że walinomycyna jest zdolna do kompleksowania wyłącznie kationów potasu i rubidu, jednak przypuszczenia te zostały szybko rozwiane. Jonofor ten tworzy kompleksy z kationami niemalże wszystkich litowców od litu po cez[24][25][26]. Selektywność kompleksowania kationów potasu i rubidu jest natomiast dużo wyższa niż kationu sodu, co ma zasadniczy wpływa na mechanizm jej działania bakteriobójczego[20]. Według czeskich naukowców mechanizm działania walinomycyny nie jest jednak związany wyłącznie z transportem kationów K+ przez błonę wewnętrzną mitochondriów, lecz równocześnie z transportem jonów hydroniowych (H3O+) w przeciwną stronę[27]. Taki transport jonów w obie strony przypomina rodzaj antyportu, nie jest to jednak transport aktywny. Badania spektroskopowe potwierdziły zdolność kompleksowania jonu hydroniowego przez walinomycynę[28]. Na podstawie badań woltamperometrycznych zasugerowano natomiast, że walinomycyna może transportować zarówno kation jak i anion[29]. Mechanizm takiego transportu nie został jeszcze wyjaśniony.
Zastosowanie
Walinomycyna wykazuje silne działanie przeciwnowotworowe[30], przeciwgrzybicze[31], przeciwbakteryjne a nawet przeciwwirusowe[32]. Jednak, jak większość antybiotyków depsypeptydowych, wykazuje wysoką toksyczność, dlatego nie może być stosowana w terapii[33][34]. Najnowsze badania in vitro dowiodły, że walinomycyna wykazuje najlepsze działanie antybiotyczne przeciw śmiertelnemu wirusowi SARS-CoV w zakażonych komórkach Vero E6. Wirus ten wywołuje zespół ostrej ciężkiej niewydolności oddechowej[35], a jego epidemia wybuchła w Chinach w 2002 roku i rozprzestrzeniła się z Dalekiego Wschodu, aż do krajów Ameryki Północnej. Walinomycyna znalazła natomiast zastosowanie w elektrodach jonoselektywnych (ISE) do wykrywania kationów potasu[36].
Zobacz też
Przypisy
- ↑ a b A. Chmiel, S. Grudziński: Biotechnologia i chemia antybiotyków. Warszawa: Wydawnictwo Naukowe PWN, 1998, s. 252-273. ISBN 83-01-12787-2.
- ↑ a b H. Brockmann, G. Schmidt-Kastner. Valinomycin I, XXVII. Mitteil. über antibiotica aus actinomyceten. „Chem. Ber.”. 88, s. 57-61, 1955. DOI: 10.1002/cber.19550880111 (niem.).
- ↑ R. Kanne. Isolation and characterization of a potassium specific ionophore from Streptococcus faecalis. „Z. Naturforschung C”. 32, s. 926-928, 1977. ISSN 0341-0382 (ang.). PubMed
- ↑ H. Ristow, J. Salnikow, H. Kleinkauf. Biosynthesis of valinomycin. „FEBS Lett.”. 2, s. 127-130, 1974. DOI: 10.1016/0014-5793(74)80768-4 (ang.).
- ↑ T. Anke, F. Lipmann. Studies on the biosynthesis of valinomycin. „FEBS Lett.”. 82, s. 337-340, 1977. DOI: 10.1016/0014-5793(77)80615-7 (ang.).
- ↑ a b B.C. Pressman, E.J. Harris W.S. Jagger, J.H. Johnson. Antibiotic-mediated transport of alkali ions across lipid barriers. „PNAS”. 58, s. 1949-1956, 1967. DOI: 10.1073/pnas.58.5.1949 (ang.).
- ↑ a b c d B.C. Pressman. Biological applications of ionophores. „Annu. Rev. Biochem.”. 45, s. 501-530, 1976. DOI: 10.1146/annurev.bi.45.070176.002441 (ang.).
- ↑ C. Moore, B.C. Pressman. Mechanism of action of valinomycin on mitochondria. „Biochem. Biophys. Res. Commun.”. 15, s. 562-567, 1964. DOI: 10.1016/0006-291X(64)90505-4 (ang.).
- ↑ M. Hofert, B.C. Pressman. Stimulation of oxidative phosphorylation in mitochondria by potassium in the presence of valinomycin. „Biochemistry”. 5, s. 3919-3925, 1965. DOI: 10.1021/bi00876a025 (ang.).
- ↑ B.C. Pressman. Inducted active transport of ions in mitochondria. „PNAS”. 3, s. 1076-1083, 1965 (ang.).
- ↑ L. Ernstern, G. Schatz. Mitochondria: A Historical Review. „J. Cell Biol.”. 91, s. 227-255, 1981 (ang.).
- ↑ E. Ogata, H. Rasmussen. Valinomycin and mitochondrial ion transport. „Biochemistry”. 5, s. 57-66, 1966. DOI: 10.1021/bi00865a009 (ang.).
- ↑ M.M. Shemyakin i inni. The structure-antimicrobial relation for valinomycin depsipeptides. „Experientia”. 21, s. 548-552, 1965. DOI: 10.1007/BF02138991 (ang.).
- ↑ G.D. Smith, W.L. Duax, i inni. Crystal and molecular structure of the triclinic and monoclinic forms of valinomycin, C54H90N6O18. „J. Am. Chem. Soc.”. 97, s. 7242–7247, 1975. DOI: 10.1021/ja00858a008 (ang.).
- ↑ I.L. Karle. Conformation of valinomycin in a triclinic crystal form. „J. Am. Chem. Soc.”. 97, s. 4379–4386, 1975. DOI: 10.1021/ja00848a041 (ang.).
- ↑ K. Neupert-Laves, M. Dobler. The Crystal Structure of a K+ Complex of Valinomycin. „Helv. Chim. Acta”. 58, s. 432-442, 1975. DOI: 10.1002/hlca.19750580212 (ang.).
- ↑ a b L.K. Steinrauf. Crystal structures of valinomycin with potassium tetrachloroaurate and rubidium tetrachloroaurate with comparisons to other monovalent cation complexes. „J. Biosci.”. 8, s. 293-306, 1985 (ang.).
- ↑ L.K. Steinrauf, J.A. Hamilton, M.N. Sabesan. Crystal structure of valinomycin sodium picrate: Anion effects on valinomycin – cation complexes. „J. Am. Chem. Soc.”. 104, s. 4085-4091, 1982. DOI: 10.1021/ja00379a008 (ang.).
- ↑ T.R. Forester, W. Smith, J.H.R. Clarke. Antibiotic activity of valinomycin. Molecular dynamics simulations involving the water/membrane interface. „J. Chem. Soc., Faraday Trans.”. 93, s. 613-619, 1997. DOI: 10.1039/A606452C (ang.).
- ↑ a b M.C. Rose, R.W. Henkens. Stability of sodium and potassium complexes of valinomycin. „BBA”. 372, s. 426-435, 1974. DOI: 10.1016/0304-4165(74)90204-9 (ang.).
- ↑ a b G. Schroeder, B. Gierczyk: Syntetyczne receptory jonowe – jonofory. Poznań: Wydawnictwo BETAGRAF P.U.H., 2005, s. 4-33, seria: Chemia Supramolekularna. ISBN 83-89936-05-4. [dostęp 2011-09-08].
- ↑ E. Makrlík, P. Vaňura, J. Hálová. Stability of Ca2+, Zn2+ and Pb2+ complexes with valinomycin in nitrobenzene saturated with water. „Pol. J. Chem.”. 81, s. 1531-1534, 2007 (ang.).
- ↑ a b E. Makrlík, P. Vaňura, P. Selucký. Experimental evidences for some unusual divalent cation complexes of valinomycin. „Monat. fur Chem. – Chemical Monthly”. 139, s. 597-600, 2008. DOI: 10.1007/s00706-007-0816-x (ang.).
- ↑ E. Makrlík, P. Vaňura. Stability of the valinomycin – lithium complex in nitrobenzene saturated with water. „J. Radioanal. Nucl. Chem.”. 267, s. 247-249, 2006. DOI: 10.1007/s10967-006-0036-6 (ang.).
- ↑ M. Daňková, E. Makrlík, P. Vaňura. Stability of the valinomycin-rubidium complex in water saturated nitrobenzene. „J. Radioanal. Nucl. Chem.”. 221, s. 251-253, 1997. DOI: 10.1007/BF02035281 (ang.).
- ↑ E. Makrlík, P. Vaňura. Stability of complex of Cs+ with valinomycin in nitrobenzene saturated with water. „J. Radioanal. Nucl. Chem.”. 214, s. 339-346, 1996. DOI: 10.1007/BF02164376 (ang.).
- ↑ J. Kříž, J. Dybal, E. Makrlík. Valinomycin–proton interaction in low-polarity media. „Biopolymers”. 82, s. 536–548, 2006. DOI: 10.1002/bip.20506 (ang.).
- ↑ J. Kříž, E. Makrlík, P. Vaňura. NMR evidence of a valinomycin–proton complex. „Biopolymers”. 81, s. 104–109, 2006. DOI: 10.1002/bip.20384.
- ↑ O. Shirai, H. Yamana, T. Ohnuki, Y. Yoshida, S. Kihara. Ion transport across a bilayer lipid membrane facilitated by valinomycin. „J. Electroanal. Chem.”. 570, s. 219–226, 2004. DOI: 10.1016/j.jelechem.2004.03.033 (ang.).
- ↑ S. Kuroda. Studies on antitumor activity of valinomycin. „Jpn. J. Cancer Chemother.”. 11, s. 2625-2632, 1984 (jap.). PubMed
- ↑ H.L. Tae, i inni. Antifungal activity of valinomycin, a cyclodepsipeptide from Streptomyces padanus TH-04. „Nat. Prod. Sci.”. 13, s. 144-147, 2007 (ang.).
- ↑ M.A. Kroteń, M. Bartoszewicz, I. Święcicka. Cereulide and valinomycin, two important natural dodecadepsipeptides with ionophoretic atcivities. „Pol. J. Microbiol.”. 59, s. 3-10, 2010. ISSN 1733-1331 (ang.).
- ↑ M.C. Pansa, G. Migliori Natalizi, S. Bettini. Toxicity of valinomycin on insects. „J. Invertebr. Pathol.”. 22, s. 148-152, 1973. DOI: 10.1016/0022-2011(73)90126-2 (ang.).
- ↑ V.V. Teplova, i inni. The higher toxicity of cereulide relative to valinomycin is due to its higher affinity for potassium at physiological plasma concentration. „Toxicol. Appl. Pharmacol”. 210, s. 39-46, 2006. DOI: 10.1016/j.taap.2005.06.012 (ang.).
- ↑ Y.-Q. Cheng. Deciphering the biosynthetic codes for the potent anti-SARS-CoV cyclodepsipeptide valinomycin in Streptomyces tsusimaensis ATCC 15141. „ChemBioChem”. 7, s. 471-477, 2006. DOI: 10.1002/cbic.200500425 (ang.).
- ↑ C. Gabrielli, i inni. Investigation of ion-selective electrodes with neutral ionophores and ionic sites by EIS. II. Application to K+ detection. „J. Electroanal. Chem.”. 570, s. 291-304, 2004. DOI: 10.1016/j.jelechem.2004.04.007 (ang.).
Linki zewnętrzne
- Karl Harrison: Valinomycin (ang.). W: 3dchem.com [on-line]. [dostęp 2011-09-15]. – model cząsteczki w 3D
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
| ||||||
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Danielchemik, Licencja: CC BY-SA 3.0
Transport jonów K+ i H3O+ przez walinomycynę w poprzek błony lipidowej
Chemical structure of valinomycin.
Autor: Danielchemik, Licencja: CC BY-SA 3.0
Schemat cząsteczki kompleksu walinomycyna z kationem potasu