Wektor genetyczny
Wektor – stosowana powszechnie w inżynierii genetycznej, niewielka cząsteczka DNA zdolna do replikacji w komórce gospodarza. Można do niej wprowadzić fragment innej cząsteczki DNA (gen), tworząc zrekombinowany DNA, który po wprowadzeniu do komórek gospodarza będzie w nich powielany[1][2]. Wektory stanowią podstawowe narzędzie klonowania DNA[1], używane w metodach otrzymywania organizmów transgenicznych[3].
Cechy wektorów
Wektor powinien wykazywać następujące cechy[1][3]:
- stanowić niewielką cząsteczkę DNA opisaną pod względem fizycznym i genetycznym
- być zdolnym do niezależnej replikacji wraz z wprowadzonym fragmentem DNA
- mieć szereg miejsc (tak zwanych polilinkerów) rozpoznawanych przez różne enzymy restrykcyjne. Każde z tych miejsc powinno być przecinane tylko przez jeden z enzymów, a w miejscu tym może być wbudowany fragment obcego DNA pociętego tym samym enzymem. Jednocześnie takie miejsca nie powinny się znajdować w takich rejonach, których uszkodzenie mogłoby zaburzać funkcje wektora.
- być łatwo wykrywalny w komórkach-gospodarzach oraz nie powinien zakłócać ich funkcji
- utrzymywać się w niezmienionej postaci niezależnie od podziałów komórki
- zawierać markery, dzięki którym można wyselekcjonować komórki, do których wniknął.
- zawierać sekwencje odpowiadające za inicjację replikacji (ori) odpowiednie dla danego gospodarza[4].
Niegdyś zadaniem wektora było również zapewnienie możliwości wprowadzenia obcego DNA do komórki biorcy oraz gwarancja, że będzie się w nich replikował autonomicznie, lub że wbuduje się do genomu gospodarza i będzie się powielał wraz z nim. Obecnie wektory, nazywane konstruktami, niekoniecznie muszą same potrafić wtargnąć do komórki (można np. stosować zabiegi typu mikroiniekcja) ani same potrafić wbudowywać się do genomu (integracja może zajść spontanicznie przez mechanizmy rekombinacji genetycznej)[5].
Typy wektorów
Można wyróżnić następujące typy wektorów:
- wektory klonujące – wektory przeznaczone do produkcji w dużej ilości kopii (klonów) wprowadzonego do nich DNA[6]
- wektory ekspresyjne – wektory zaprojektowane specjalnie dla osiągania wysokiej ekspresji klonowanego genu w komórkach gospodarzach[7]. Ich cechą charakterystyczną jest posiadanie silnych promotorów, które zapewniają wysoki poziom transkrypcji genów. Dzięki temu komórka może produkować duże ilości kodowanego przez nie, rekombinowanego białka[8]. Do silnych promotorów należy m.in. promotor z operonu lac, promotor z operonu trp, promotor tac, promotor T7 (dla polimerazy RNA faga T7)[9]
- wektory wahadłowe – wektory, który mogą powielać się w komórkach więcej niż jednego organizmu[10]. Przykładowo klonowanie DNA w Saccharomyces cerevisiae jest stosunkowo mało wydajne i, jeśli zachodzi konieczność identyfikacji szukanego rekombinanta w mieszaninie różnych klonów, istnieje ryzyko, że nie otrzyma się wystarczającej ich liczby, by znaleźć ten właściwy. Dlatego selekcję w tym wypadku łatwiej przeprowadzić w Escherichia coli jako gospodarzu, a dopiero po odnalezieniu odpowiednich klonów przenieść ich rekombinowane DNA do komórek Saccharomyces cerevisiae[11].
Rodzaje wektorów
Wektory prokariotyczne
Wektory plazmidowe
Plazmidy stosowane w inżynierii genetycznej są skonstruowane z naturalnych plazmidów bakteryjnych (lub drożdży)[1]. Są one stosunkowo niewielkimi, pozachromosomowymi kolistymi cząsteczkami DNA. Ich replikacja jest zupełnie niezależna od replikacji chromosomu bakteryjnego[3] dzięki posiadaniu miejsc inicjacji replikacji (ori)[12]. Nie zawierają genów niezbędnych dla przeżycia komórki, jednak mogą być nośnikiem użytecznych cech, jak geny oporności na antybiotyki, które można potem wykorzystać w selekcji[13]. Plazmidy u eukariontów są rzadkie. Jeden plazmid w komórce mają, na przykład, komórki Saccharomyces cerevisiae, który czasami wykorzystuje się do klonowania[14].
Wektor generalnie powinien być stosunkowo niewielki, najlepiej o rozmiarze poniżej 10 kpz, ponieważ większe są trudne w manipulacji[15]. Wielkość plazmidów bakteryjnych waha się między 1 kpz a ponad 250 kpz[16], co ogranicza zastosowanie wielu z nich w inżynierii genetycznej.
Dzięki posiadaniu miejsc wielokrotnego klonowania wektory mogą zostać przecięte w jednym miejscu przez jeden z odpowiednich enzymów restrykcyjnych i w procesie ligacji włączyć cząsteczkę obcego DNA (tzw. insert, „wstawka”) przeciętą tym samym enzymem. Wektory mogą jednak się również zamknąć bez włączenia obcego DNA (autoligacja)[12].
Takie plazmidy mogą być pobrane przez komórkę dzięki osiągnięciu stanu kompetencji, kiedy błony stają się przepuszczalne dla DNA. W tym celu komórki można inkubować w stężonym roztworze soli wapniowych[12], stosować szok cieplny[16]. Można również wprowadzić DNA w wyniku podziałania silnym impulsem elektrycznym (elektroporacja). Wraz z podziałami komórkowymi powstają nowe klony komórek (widocznych jako kolonie bakterii), a z nich można wyizolować klonowany DNA)[12].
Wprowadzanie obcego DNA, bez odpowiedniego wzorca metylacji, do zwyczajnej komórki bakterii skończyłoby się jego degradacją ze względu na bakteryjny system restrykcji i modyfikacji. W biologii molekularnej stosuje się jednak specjalne zmutowane szczepy bakterii, u których system ten jest nieaktywny, na przykład Escherichia coli DH5α[12].
Do najpopularniejszych wektorów plazmidowych należą wektory z serii pUC. Zostały one skonstruowane na podstawie plazmidu pBR322, a ten z kolei powstał przez ligację fragmentów restrykcyjnych z trzech naturalnie występujących plazmidów Escherichia coli (R1, R6.5 i pMB1). Przykładowo plazmid pUC19 ma rozmiar 2,7 kpz, posiada miejsce startu replikacji (ori) oraz 2 geny markerowe: gen odporności na ampicylinę (amp) oraz fragment genu kodującego enzym β-galaktozydazę (lacZα)[17].
Gen odporności na ampicylinę nadaje zdolność produkcji β-laktamazy, rozkładającej ten antybiotyk. Komórki nieposiadające tego genu nie rosną w obecności tego antybiotyku w pożywce. W ten sposób można wyselekcjonować bakterie, które przyjęły plazmid pUC19 (i nie są wrażliwe na ampicylinę)[17].
Gen lacZα koduje część enzymu β-galaktozydazy katalizującego rozkład laktozy na glukozę i galaktozę. Szczepy Escherichia coli używane do eksperymentów mają zmodyfikowany gen lacZ w taki sposób, że brakuje im peptydu α kodowanego właśnie przez gen lacZα znajdujący się w plazmidzie pUC19. Jednocześnie w obrębie tego genu w plazmidzie znajdują się unikatowe miejsca restrykcyjne (polilinker). Jeśli więc nastąpiło przecięcie plazmidu przez enzymy restrykcyjne i wbudowanie w to miejsce obcego DNA, to gen ten będzie przerwany i nieaktywny – nie będzie produkcji enzymu β-galaktozydazy[17].
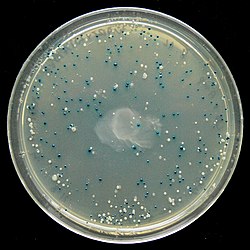
Obecność enzymu łatwo jest uwidocznić, ponieważ enzym ten przekształca syntetyczny substrat nazywany X-gal w niebieski produkt. Po dodaniu więc do pożywki X-gal, IPTG (aktywatora genu lacZ) oraz ampicyliny wyrosną tylko kolonie komórek z wektorem bez insertu zabarwione na niebiesko oraz pożądane białe kolonie z wektorem i rekombinowanym DNA[17].
Wektory bakteriofagowe
Bakteriofagi (fagi) są wirusami infekującymi bakterie w procesie transdukcji. Są zbudowane z DNA (rzadko z RNA) i ochraniającego płaszcza białkowego. W inżynierii genetycznej używa się głównie bakteriofagów λ i bakteriofagów M13 jako wektorów klonalnych[18]. Główną zaletą bakteriofagów jest możliwość wklonowania większych fragmentów DNA niż do plazmidów, o długości do 25 kpz (w przypadku plazmidów jest to poniżej 10 kpz)[19].
Bakteriofagi mogą wchodzić w cykl lityczny, kiedy to fag wprowadza swoje DNA do komórki bakterii, następuje jego replikacja, synteza białek kapsydowych, składanie nowych wirusów i uwalnianie ich powodujące lizę (śmierć) komórki bakteryjnej. Proces jest bardzo szybki, może trwać nawet mniej niż 20 minut. W cyklu lizogenicznym DNA faga jest włączane w genom bakteryjny. Nazywane jest wtedy profagiem, znajduje się w stanie wyciszonym i powiela się wraz z podziałami komórki (nawet przez tysiące podziałów). W końcu jednak profag jest uwalniany i następuje przejście do fazy litycznej. Cykl lizogeniczny jest charakterystyczny dla bakteriofaga λ[18], ale większość wektorów skonstruowanych na jego podstawie jest tak zmodyfkowanych, by wirus od razu wchodził w cykl lityczny[20].
W przypadku bakteriofaga M13 cykl infekcyjny jest nietypowy. Po infekcji Escherichia coli DNA wirusa nie jest włączany w genom bakteryjny i jego geny ulegają ekspresji, nowe wirusy są stale składane i uwalniane z komórki, faza lityczna nigdy nie następuje, a komórki bakteryjne dzielą się dalej, choć w wolniejszym tempie[18].
Genom bakteriofaga λ stanowi dwuniciowa cząsteczka DNA o wielkości 48,5 kpz. W dojrzałych cząstkach wirusowych występuje w formie liniowej z 12-nukleotydowymi jednoniciowymi, komplementarnymi względem siebie końcami zwanymi cos. Dzięki nim w komórce bakteryjnej może przybrać formę kolistą[21]. Z DNA wirusa można usunąć 15 kpz zawierających niepotrzebne geny do integracji fagowego DNA z chromosomem bakterii[22], pozostawiając lewe i prawe ramiona, a w miejsce usuniętego fragmentu można wstawić obce DNA i wprowadzić z powrotem do kapsydu faga w procesie nazywanym pakowaniem. Takie zrekombinowane fagi są wysiewane na szalkę, na której wyhodowano wcześniej warstwę bakterii zwaną murawą lub dywanikiem. W miejscach, gdzie komórki bakteryjne uległy lizie spowodowanej infekcją fagiem, pojawiają się czyste pola wielkości główki od szpilki nazywane łysinkami[19], stanowiące odpowiedniki pojedynczych kolonii bakteryjnych[23]. Łysinki można wyizolować i użyć do infekcji świeżych komórek Escherichia coli[19].
Bakteriofag M13 należy do bakteriofagów filamentowych, jego genom jest wielkości 6,4 kpz i stanowi go kolista, jednoniciowa cząsteczka DNA[24]. Po wniknięciu DNA do komórki bakteryjnej syntetyzowana jest komplementarna nić i następuje powielanie takiej dwuniciowej, kolistej formy DNA zwanej formą replikacyjną (RF, od ang. replicative form) aż do uzyskania około 100 kopii w komórce. Takie formy można oczyszczać i stosować tak jak plazmid. Jednocześnie powstają cząsteczki jednoniciowego DNA, opakowywane kapsydem i uwalniane jako nowe cząstki wirusowe. Taki jednoniciowy DNA przydatny może być, na przykład, do sekwencjonowania lub mutagenezy ukierunkowanej. Zainfekowanie tym fagiem murawy bakterii powoduje pojawienie się pseudołysinek, spowodowanych wolniejszym wzrostem bakterii w tych miejscach[25].
Kosmidy
Kosmidy stanowią sztucznie stworzone wektory, które powstały z połączenia plazmidu i sekwencji cos bakteriofaga λ[3]. Są niewielkich rozmiarów (4–6 kpz) i mogą przyjmować fragmenty obcego DNA do 47 kpz. Zrekombinowane kosmidy pakowane są w kapsydy λ[3], wykorzystują mechanizm wirusów do wtargnięcia do komórki bakteryjnej[26]. Dzięki sekwencji cos tworzą formę kulistą, replikują się jak plazmidy i nie niszczą zainfekowanej komórki[3].
Wektory eukariotyczne
Większość wektorów stosowanych w komórkach eukariotycznych opiera się na genomach wirusowych lub sztucznych chromosomach[14]. Wiele wektorów eukariotycznych zawiera również sekwencje pozwalające również na replikację w komórkach Escherichia coli (są wektorami wahadłowymi)[27].
Agroinfekcja
W sposób odmienny od typowych bakteryjnych plazmidów działa plazmid Ti pochodzący od bakterii glebowej Agrobacterium tumefaciens[19]. Są to bakterie atakujące rośliny, powodujące tworzenie charakterystycznych rakowatych narośli na korzeniach[28]. Jednak żadne plazmidy nie występują naturalnie w komórkach roślin wyższych[29]. Podczas infekcji fragment plazmidu Ti nazywany T-DNA wnika do komórki roślinnej i integruje z jej chromosomowym DNA[19]. W wektorach opartych na tych plazmidach geny wywołujące chorobę zastąpione są pożądanymi genami, na przykład genami odporności na herbicydy albo choroby. Do procesów tych używa się komórek kalusowych, z których w odpowiednich warunkach można odtworzyć całą roślinę[28]. W naturze Agrobacterium tumefaciens infekuje tylko rośliny dwuliścienne, jednak w pewnym stopniu ograniczenia te udało się przezwyciężyć i możliwe jest również infekowanie jednoliściennych[30][31].
Sztuczne chromosomy drożdżowe
Sztuczne chromosomy drożdżowe mogą być stosowane do klonowania bardzo długich fragmentów DNA, do 5 milionów pz[1], co umożliwia klonowanie całych ludzkich genów[32]. Skonstruowane są na podstawie części chromosomu Saccharomyces cerevisiae niezbędnych do replikacji takich jak miejsce początku replikacji, centromer (do segregacji chromosomów w potomnych komórkach), telomery (do stabilizacji końców chromosomu)[19]. Mają poza tym geny markerowe i polilinkery. Często wektory drożdżowe konstruuje się jako wektory wahadłowe, zdolne do namnażania zarówno w komórkach drożdży, jak i Escherichia coli[33].
Sztuczne chromosomy drożdżowe często zastępuje się podobnymi sztucznymi chromosomami bakteryjnymi, które są stabilniejsze, choć mogą przyjmować mniejsze inserty do 350 kpz[19]. Są one skonstruowane na podstawie plazmidu koniugacyjnego (tzw. czynnik F)[12]. Stosuje się je powszechnie do mapowania genomów[34].
Sztuczne chromosomy drożdżowe można również z powodzeniem wprowadzać do komórek roślin i zwierząt, jednak nie powiela się on w nich autonomicznie – może ulec integracji z genomem gospodarza[35].
Wirusy jako wektory eukariontów
Do komórek ssaków można wprowadzać obce geny za pośrednictwem wirusów. Jednym z pierwszych zastosowanych był wirus SV40. Nie może on jednak wprowadzać dużych fragmentów DNA[36]. Stosowane mogą być ponadto adenowirusy i retrowirusy. Choć liczono, że staną się podstawowym wektorem ssaków, w latach 90. XX w. okazało się, że najefektywniejszym, choć niedoskonałym, sposobem na wprowadzenie genu do takich komórek jest zastosowanie mikroiniekcji (wstrzykiwanie plazmidów bakteryjnych lub liniowych kopii genu, które mają być włączone w genom)[37].
Poza tym w inżynierii genetycznej stosuje się bakulowirusy. Są to wirusy infekujące owady, nieinfekujące kręgowców[38]. W DNA wirusa znajduje się gen kodujący białko poliedrynę, którego ekspresja regulowana jest przez silny promotor, dlatego produkowane jest ono w dużych ilościach. Pod kontrolą tego promotora można przeprowadzić z powodzeniem nadekspresję obcego, wprowadzonego genu. Stosuje się więc ten wektor do produkcji białek zwierzęcych w komórkach owadzich na dużą skalę. W komórkach tych zachodzi wiele niezbędnych potranslacyjnych modyfikacji takich białek, które niemożliwe są w komórkach bakterii[36], choć przykładowo glikozylacja nie zawsze przebiega zadowalająco[38].
Sztuczne chromosomy ssaków
Na podstawie sztucznego chromosomu drożdżowego podjęto próby opracowania sztucznego chromosomu ssaków (MAC, od ang. mammalian artificial chromosome)[12], wśród nich sztuczne chromosomy ludzkie (HAC, od ang. human artificial chromosome)[1]. Podobnie jak w przypadku wektorów drożdżowych, posiadają sekwencje centromerowe, sekwencje inicjujące replikację DNA oraz sekwencje telomerowe. Replikacja i segregacja takich wektorów zachodzi w komórkach ssaków autonomicznie[12], jednak wektory tego typu nastręczają wielu trudności i wymagają jeszcze udoskonaleń[39].
Zobacz też
Przypisy
- ↑ a b c d e f Charon K. M., Świtoński M.: Genetyka i Genomika Zwierząt. Warszawa: Wydawnictwo Naukowe PWN, 2012, s. 136–139. ISBN 978-83-01-17107-0.
- ↑ Brown 2010 ↓, s. 311.
- ↑ a b c d e f Drewa G., Olszewska-Słonina D., Bratkowska W., Woźniak A., Ferenc T.: Inżynieria Genetyczna. W: Drewa G., Ferenc T.: Podstawy Genetyki dla Studentów i Lekarzy. Elsevier, 2003, s. 406–413. ISBN 83-87944-83-1.
- ↑ Węgleński 2017 ↓, s. 116.
- ↑ Buchowicz 2009 ↓, s. 53–54.
- ↑ Rédei G. P.: Encyclopedia of Genetics, Genomics, Proteomics and Informatics. Springer Netherlands, 2008, s. 375. DOI: 10.1007/978-1-4020-6754-9_3171. ISBN 978-1-4020-6753-2.
- ↑ Brown 2010 ↓, s. 146.
- ↑ Brown 2010 ↓, s. 228–232.
- ↑ Brown 2010 ↓, s. 231–232.
- ↑ Brown 2010 ↓, s. 309.
- ↑ Brown 2013 ↓, s. 54.
- ↑ a b c d e f g h L. A. Allison: Podstawy Biologii Molekularnej. Warszawa: Wydawnictwa Uniwersytetu Warszawskiego, 2007, s. 195–199. ISBN 978-83-235-0527-3.
- ↑ Nicholl 2008 ↓, s. 66.
- ↑ a b Brown 2013 ↓, s. 44.
- ↑ Brown 2010 ↓, s. 13.
- ↑ a b Sadakierska-Chudy A., Dąbrowska G., Goc A.: Genetyka Ogólna. Toruń: Wydawnictwo Uniwersytetu Mikołaja Kopernika, 2004, s. 56–59. ISBN 83-231-1710-1.
- ↑ a b c d Brown 2013 ↓, s. 45–47.
- ↑ a b c Brown 2010 ↓, s. 17–19.
- ↑ a b c d e f g Fletcher H., Hickey I., Winter P.: Krótkie Wykłady. Genetyka. Warszawa: Wydawnictwo Naukowe PWN, 2010, s. 346–350. ISBN 978-83-01-16343-3.
- ↑ Brown 2010 ↓, s. 40.
- ↑ Węgleński 2017 ↓, s. 120.
- ↑ Brown 2013 ↓, s. 49.
- ↑ Turner i in. 2007 ↓, s. 153.
- ↑ Brown 2010 ↓, s. 22.
- ↑ Turner i in. 2007 ↓, s. 154.
- ↑ Nicholl 2008 ↓, s. 80.
- ↑ Turner i in. 2007 ↓, s. 163.
- ↑ a b Cichocki M.: Organizmy zmodyfikowane genetycznie w farmacji i medycynie. W: Licznerska B., Ignatowicz E., Baer-Dubowska W.: Biologia Molekularna dla Farmaceutów. Poznań: Wydawnictwo Naukowe Uniwersytetu Medycznego im. Karola Marcinkowskiego w Poznaniu, 2012, s. 33–34. ISBN 978-83-7597-146-0.
- ↑ Brown 2010 ↓, s. 113.
- ↑ Sood P. A. Bhattacharya, Sood A.. Problems and Possibilities of Monocot Transformation. „Biologia Plantarum”. 55 (1), s. 1–15, 2011. DOI: 10.1007/s10535-011-0001-2.
- ↑ Brown 2010 ↓, s. 117.
- ↑ Turner i in. 2007 ↓, s. 159–160.
- ↑ Węgleński 2017 ↓, s. 122.
- ↑ Turner i in. 2007 ↓, s. 161.
- ↑ Buchowicz 2009 ↓, s. 47–48.
- ↑ a b Turner i in. 2007 ↓, s. 166.
- ↑ Brown 2010 ↓, s. 123–124.
- ↑ a b Brown 2010 ↓, s. 240.
- ↑ Basu J., Willard H. F.. Artificial and Engineered Chromosomes: Non-integrating Vectors for Gene Therapy. „Trends in Molecular Medicine”. 11 (5), s. 251–258, 2005. DOI: 10.1016/j.molmed.2005.03.006.
Bibliografia
- T. A. Brown: Genomy. Warszawa: Wydawnictwo Naukowe PWN, 2013. ISBN 978-83-01-15634-3.
- P. Węgleński: Genetyka molekularna. Warszawa: Wydawnictwo Naukowe PWN, 2017. ISBN 978-83-01-14744-0.
- P. Turner, A. McLennan, A. Bates, M. White: Krótkie Wykłady. Biologia molekularna. Warszawa: Wydawnictwo Naukowe PWN, 2007. ISBN 978-83-01-14146-2.
- D. S. T. Nicholl: An Introduction to Genetic Engineering. Warszawa: Cambridge University Press, 2008. ISBN 978-0-521-85006-3.
- T. A. Brown: Gene Cloning & DNA Analysis. Wiley-Blackwell, 2010. ISBN 978-1-4051-8173-0.
- J. Buchowicz: Biotechnologia molekularna. Warszawa: Wydawnictwo Naukowe PWN, 2009, s. 47–48. ISBN 978-83-01-15956-6.
Media użyte na tej stronie
Autor: Stefan Walkowski, Licencja: CC BY-SA 4.0
Test blue-white. Płytka agarowa z wyrośniętymi białymi i niebieskimi koloniami E. coli.
scheme of pUC19 plasmid