Wodór
Wodór (H, łac. hydrogenium) – pierwiastek chemiczny o liczbie atomowej 1[9], niemetal z bloku s układu okresowego. Wodór jest najczęściej występującym pierwiastkiem chemicznym we Wszechświecie i jednym z najczęściej spotykanych pierwiastków na Ziemi[10]. Posiada najmniejszą masę atomową, wynoszącą 1,00794 u. Najczęściej występującym izotopem wodoru jest prot (1
H), który posiada atom o najprostszej możliwej budowie – składa się z jednego protonu i jednego elektronu.
Wodór w formie atomowej powstał w epoce rekombinacji. W warunkach standardowych, wodór gazowy występuje w formie cząsteczkowej H
2, jako bezbarwny, bezwonny, bezsmakowy, nietoksyczny, łatwopalny gaz. W skrajnie wysokich temperaturach możliwe jest jego uzyskanie w formie atomowej H. Ponieważ ten pierwiastek łatwo tworzy związki chemiczne z większością pierwiastków będących niemetalami, większość wodoru na Ziemi występuje w postaci wody lub związków organicznych. Wodór odgrywa szczególnie istotną rolę w reakcjach kwasowo-zasadowych, ponieważ większość tego typu reakcji wiąże się z wymianą protonów między rozpuszczalnymi cząsteczkami. W związkach jonowych wodór może posiadać ładunek ujemny (anion H−
) lub dodatni (kation H+
). Ponieważ wodór jest jedynym neutralnym atomem, dla którego równanie Schrödingera można rozwiązać analitycznie, badania energetyki i wiązań wodoru odegrały kluczową rolę w rozwoju mechaniki kwantowej.
Wodór po raz pierwszy otrzymano sztucznie na początku XVI wieku w reakcji metalu z kwasem. W latach 1766–1781 Henry Cavendish był pierwszą osobą, która stwierdziła, że wodór jest oddzielną substancją chemiczną, po spaleniu której powstaje woda. Ta właściwość zadecydowała o nazwie tego pierwiastka chemicznego, ponieważ w języku greckim υδρογόνο (ydrogóno) oznacza „tworzący wodę”.
Produkcja przemysłowa wodoru odbywa się głównie metodą reformingu parowego gazu ziemnego, rzadziej zaś przy użyciu bardziej energochłonnych metod, takich jak elektroliza wody. Zdecydowana większość otrzymanej w ten sposób substancji spożytkowywana jest w okolicach miejsca produkcji. Dwa największe obszary zastosowań tak otrzymanego wodoru to przetwarzanie paliw kopalnych (np. hydrokraking) i produkcja amoniaku, głównie do zastosowania na rynku nawozowym.
Pochodzenie i występowanie
Stanowiąc około 75% (masowo) całości materii, wodór jest najpowszechniej występującym pierwiastkiem we Wszechświecie[11][12]. Według teorii Wielkiego Wybuchu, wodór jest pierwiastkiem powstałym w bardzo wczesnym etapie rozwoju Wszechświata (podczas Wielkiego Wybuchu powstała także większość jąder helu oraz część istniejących obecnie jąder litu i berylu). Początkowo materia Wszechświata składała się z promieniowania i cząstek o bardzo wysokiej energii (w tym z fotonów, elektronów, protonów, neutronów, cząstek neutrino oraz antycząstek). W miarę wychładzania się materii, w czasie około stu sekund od początku Wielkiego Wybuchu, temperatura spadła do miliarda stopni Celsjusza. W takiej temperaturze energia cząstek była już zbyt mała, aby pokonać siłę międzyatomowego oddziaływania silnego, skutkiem czego było łączenie się protonów i neutronów w jądro deuteru, jądro helu oraz małe ilości litu i berylu. Większość protonów pozostała niepołączona tworząc później atomy głównego izotopu wodoru[13][11].
W dużych ilościach wodór występuje np. w gwiazdach (w tym w Słońcu), materii międzygwiazdowej oraz w przestrzeni międzyplanetarnej[14][15]. Chmury wodorowe (mgławice wodoru cząsteczkowego H
2, zwane obszarami H II) są miejscem narodzin nowych gwiazd[16].
Wodór na Ziemi występuje niemal wyłącznie w związkach chemicznych np. w:
- złożach gazu ziemnego (składającego się głównie z metanu), którego bogate złoża znajdują się m.in. w Iranie, Katarze czy Rosji;
- gazach wulkanicznych[17];
- powietrzu – w śladowych ilościach ok. 0,019%[17].
Historia i etymologia
Pierwsze obserwacje wodoru przypisuje się szwajcarskiemu alchemikowi Paracelsusowi. Wykonywał on eksperymenty polegające na wrzucaniu metali do kwasów i zbieraniu do naczyń gazowych produktów tych reakcji. W swoim dziele Archidoxa odnotował on, że powietrze powstałe w wyniku połączenia żelaza i rozcieńczonego kwasu solnego „unosi się i wybucha jak wiatr” (Lufft sich erhebt und herfür bricht gleich wie ein Wind)[18]. Niejednoznaczność opisu powstałego zjawiska sprawia, że nie jest do końca jasne, czy gazem, który zaobserwował, był rzeczywiście wodór czy powstające pęcherzyki powietrza[19]. Do dzisiaj reakcja metali z kwasami stanowi najprostszy sposób otrzymywania wodoru w warunkach laboratoryjnych.
W XVII wieku eksperymenty Paracelsusa powtórzył Théodore Turquet de Mayerne. Zauważył on, że gaz powstały w reakcji żelaza z kwasem solnym jest łatwopalny[20].
W 1671 roku Robert Boyle opublikował Tracts containing new experiments touching the relation betwixt flame and air[b][21], w którym opisał wybuchową naturę mieszanki wodoru z powietrzem, powstałej w wyniku reakcji opiłków żelaza z kwasami, nazywając ją Inflammable solution of Mars (łatwopalnym roztworem Marsa[c]).
Pierwszą osobą, która uznała wodór za odrębną substancję (flogiston) był Henry Cavendish. W 1766 r. zamieścił on w swoich notatkach wyniki i wnioski ze swoich badań[22]. Substancja ta została uznana za pierwiastek dzięki badaniom Antoine’a Lavoisiera nad otrzymywaniem wody z wodoru i tlenu w 1783 r. Lavoisier nadał wodorowi nazwę hydrogenium oznaczającą „rodzący wodę”. Nazwa ta pochodzi z greckiego i jest połączeniem dwóch wyrazów „hydōr” (ὕδωρ) oznaczający „wodę” oraz „genes” (-γενής) oznaczający „tworzący”, „rodzący”. Nazwa ta rozprzestrzeniła się w Europie i do dzisiaj jej pochodne są używane w wielu językach. Przykładem jest angielskie słowo „hydrogen” lub francuskie „Hydrogène”.
Lavoisier prowadził badania nad zachowaniem masy. Odparowując i skraplając wodę w układzie zamkniętym, próbował on udowodnić, że masa wody pozostaje stała. Po skropleniu okazywało się jednak, że masa była mniejsza. Powodem była reakcja wody z żelazem (z którego wykonany był aparat) w wysokiej temperaturze, w wyniku której powstawał wodór[23]:
- Fe + H
2O → FeO + H
2- 2Fe + 3H
2O → Fe
2O
3 + 3H
2- 3Fe + 4H
2O → Fe
3O
4 + 4H
2 - 2Fe + 3H
Lavoisier obalił teorię flogistonu i udowodnił, że woda jest produktem spalania wodoru. Popularyzatorami teorii Lavoisiera na ziemiach polskich byli przede wszystkim bracia Jan i Jędrzej Śniadeccy. Pierwszy z nich, Jan, był wykładowcą na Akademii Krakowskiej. W 1780 roku odbył kilka kursów chemii w Paryżu. Tam po raz pierwszy zetknął się z teoriami Lavoisiera[24]. Do Paryża powrócił w latach 1790–1810, początkowo jako stypendysta, a następnie profesor Akademii Krakowskiej[25]. Jędrzej Śniadecki był profesorem na Uniwersytecie Wileńskim, gdzie wykładał chemię w języku polskim. Był autorem pierwszej polskiej terminologii chemicznej. W 1800 roku wydał podręcznik do chemii, w którym po raz pierwszy użył nazwy „wodoród”[26], zastępując nią łacińską nazwę „hydrogenium”.
Daiémy piérwiastkowi, o którym mowa, nazwisko wodo-rodu (hydrogenium), ponieważ iest częścią składaiącą wody; i z niéy go nayczęściéy otrzymuiémy (...) Dawniéysi Autorowie nazywali gaz wodorodny powiétrzem palnym (aér inflammabilis), gaz alebowiém tén ieżeli się przy wolnym przystępie powiétrza zetknie z ciałami palącémi się, zapala się i płonie lekkim blado-różowém płomieniem (...) Lekkość tégo gazu tak iest znaczná, iż podług Kirwana, ciężar iégo tak się ma do ciężaru powiétrza atmosfery=84:1000, a zatém że dwanaście razy blisko od tegoż powiétrza iest lżeyszy (...) Naymocnéyszé detonacyé zdarzaią się zmieszawszy część iednę gazu kwasorodnégo, z dwoma wodorodnégo, dla czégo mieszaninę tę nazwano powietrzem huczącém (Knalluft).
Z biegiem czasu została skrócona do powszechnie dziś znanej nazwy „wodór”, którą zaproponował Filip Walter, co zatwierdziła krakowska Akademia Umiejętności na posiedzeniu w 1900 roku[27]. W oparciu o sprawozdanie z tego posiedzenia redakcja „Chemika Polskiego” opublikowała w 1902 roku Słowniczek Chemiczny, w którym sugeruje używanie nazwy „wodór”[28].
Odkrycie Lavoisiera spowodowało, że różne ośrodki naukowe zajęły się badaniem właściwości wodoru. W Polsce badaniem wodoru zajmowali się m.in. Zygmunt Wróblewski[29] i Karol Olszewski[30][31][32][33][34][35][36][37][38] z Uniwersytetu Jagiellońskiego. W 1884 roku przeprowadzili oni nieudaną próbę skroplenia wodoru (udało im się uzyskać jedynie mgłę). Pod koniec życia Zygmunt Wróblewski przeprowadził eksperymenty, dzięki którym udało się mu w 1885 roku wyznaczyć stałe krytyczne wodoru. Dane te potwierdził eksperymentalnie Karol Olszewski w 1906 roku[30].
W 1898 roku szkocki chemik James Dewar po raz pierwszy skroplił wodór wykorzystując do tego celu skonstruowaną przez siebie kolbę próżniową[39][40][41]. Rok później udało mu się uzyskać wodór w postaci stałej[42][43]. Deuter został odkryty przez Harolda Ureya w 1931 roku a trzy lata później, w 1934 roku, Ernest Rutherford, Mark Oliphant i Paul Herteck odkryli tryt[44].
Zastosowanie
Przemysł chemiczny
Wodór znajduje szerokie zastosowanie w przemyśle chemicznym oraz petrochemicznym. Wykorzystywany jest głównie w procesach redukcji i uwodornienia[45]. Przykładami procesów, w których stosowany jest wodór są:
- synteza amoniaku, który następnie wykorzystywany jest w produkcji nawozów sztucznych (na bazie azotanu amonu lub mocznika)[46]. Synteza amoniaku przebiega według ogólnej reakcji:
- N
2 + 3H
2 ⇄ 2NH
3
- hydrorafinacja – katalityczny proces chemiczny stosowany w przemyśle rafineryjnym w celu obniżenia zawartości związków siarki, azotu i tlenu oraz wysycenia wiązań podwójnych w produktach i półproduktach przeróbki ropy naftowej oraz jej pozostałościach destylacyjnych, a także w przemyśle koksochemicznym.
- hydrokraking – grupa procesów technologicznych stosowanych w celu przerobu ciężkich frakcji ropy naftowej na benzynę i oleje.
- reforming – proces katalitycznego przetwarzania wstępnie hydrorafinowanych frakcji benzynowych i lekkich frakcji naftowych w obecności wodoru w celu podwyższenia ich liczby oktanowej.
- synteza metanolu – proces, w którym cząsteczki wodoru reagują z cząsteczkami tlenku węgla, dające w rezultacie metanol[45]. Ponieważ pośród reagentów występuje również dwutlenek węgla konieczny do podtrzymania aktywności katalizatora, to zachodzące reakcje można zapisać następująco:
- CO + 2H
2 ⇄ CH
3OH- CO
2 + 3H
2 ⇄ CH
3OH + H
2O - CO
- uwodornienie benzenu do cykloheksanu, który jest wykorzystywany w produkcji nylonu[45].
- hydroformylowanie – proces OXO, służący do przemysłowego otrzymywania aldehydów w wyniku reakcji alkenów z gazem syntezowym. Otrzymane aldehydy są w kolejnym etapie najczęściej przetwarzane do alkoholi.
- RCH=CH
2 + CO + H
2 → RCH
2CH
2CHO
- produkcja aniliny poprzez uwodornienie nitrobenzenu (w obecności katalizatora, np. SnCl
2):
Przemysł spożywczy
Wodór znajduje się na liście substancji dopuszczonych do stosowania w przemyśle spożywczym i jest oznaczony symbolem E-949. Podstawowym aktem prawnym regulującym stosowanie dodatków do żywności w Unii Europejskiej jest rozporządzenie Parlamentu Europejskiego i Rady (WE) nr 1333/2008 z dnia 16 grudnia 2008 r.[47] w sprawie dodatków do żywności (Dz. Urz. UE L 354, 31.12.2008) oraz rozporządzenie Komisji (UE) nr 1129/2011 z dnia 11 listopada 2011 r.[48] (Dz. Urz. UE L 295 z dnia 12.11.2011)[49]. W Polsce rozporządzenia te zostały wdrożone rozporządzeniem ministra zdrowia z dnia 22 listopada 2010 roku (Dz.U.10.232.1525)[50]. Zgodnie z europejskimi dyrektywami 2010/67/UE z dnia 20 października 2010 r.[51] oraz 2008/84/WE z dnia 27 sierpnia 2008 r.[52], określającymi czystość substancji chemicznych stosowanych w przemyśle spożywczym, wodór nie może zawierać więcej niż 0,005% obj. wody, 0,001% obj. tlenu oraz 0,07% obj. azotu.
Głównym zastosowaniem wodoru w przemyśle spożywczym jest proces utwardzania (uwodornienia) wielonienasyconych tłuszczów roślinnych, w wyniku którego powstaje margaryna. W procesie tym podwójne i potrójne wiązania zostają rozerwane, a wolne wiązania przyłączają pojedyncze atomy wodorowe[53].
Przykładami takich procesów są np. metoda Normanna lub metoda Wilbuszewicza[54]. Obie metody polegają na traktowaniu płynnego oleju wodorem w obecności katalizatora (którymi są najczęściej nikiel, platyna, miedź lub pallad)[55]. Prowadzi to do uwodornienia – przyłączenia atomów wodoru do wiązań podwójnych i potrójnych, dając w rezultacie stałe oleje nasycone (np. margarynę).
Wodoru używa się również do syntezy sorbitolu – substancji słodzącej o symbolu E-420:
Przemysł metalurgiczny
W przemyśle metalurgicznym wodór używany jest do redukcji rudy żelaza. Wodór wykorzystywany jest w mieszaninie z tlenkiem węgla, który jest źródłem węgla potrzebnym do produkcji stali z surowego żelaza otrzymywanego w tym procesie[45]. Przykładami reakcji redukcji rud żelaza są[56]:
- 3Fe
2O
3 + H
2 ⇄ 2Fe
3O
4 + H
2O- Fe
3O
4 + H
2 ⇄ 3FeO + H
2O- FeO + H
2 ⇄ Fe + H
2O - Fe
Aeronautyka
Pierwszy balon wypełniony wodorem został zbudowany już w 1783 roku przez francuskiego konstruktora Jacques’a Charles’a. Pierwszy lot odbył się 26[57] lub 27[58] sierpnia 1783 roku. Był to niewielki balon o objętości około 35 metrów sześciennych[58] i udźwigu mniej więcej 9 kg[57]. Wodór był wytwarzany w dużej beczce[59], w której umieszczono 540 kg[60] żelaznego złomu[58] i poddano reakcji z 270 kg kwasu siarkowego – w tak dużej skali wodór został otrzymany wówczas po raz pierwszy, wcześniej otrzymywano tylko jego niewielkie ilości[60]. Wytworzony gaz był transportowany do balonu za pomocą ołowianych rur[58], a jego napełnianie trwało 4 dni[60]. Ponieważ nośność 9 kg była zbyt mała do zabrania osoby, przygotowano drugi lot, tym razem w balonie o objętości 380 m³[58]. Start pierwszego lotu balonu wypełnionego wodorem z osobami w gondoli odbył się 1 grudnia 1783 roku w ogrodach Tuileries, dzielnicy Paryża i zgromadził około 400 tys. oglądających[59]. Balon pokonał w ciągu 2 h około 36 km, następnie wylądował, jeden z pasażerów opuścił pokład i wtedy Jacques Charles samodzielnie wzbił się nim na wysokość blisko 10000 stóp[58] (3 km).
Pierwszą udokumentowaną ofiarą eksplozji balonu wypełnionego wodorem był Pilâtre de Rozier, który 15 czerwca 1785 próbował przelecieć nad Kanałem La Manche[61].
Wydłużająca się lista wypadków z udziałem statków powietrznych unoszonych wodorem[62] sprawiła, że zaczęto opracowywać konstrukcje unoszone helem, ponieważ zrozumiano, że wodór jest zbyt niebezpieczny. Helu użyto również przy projektowaniu sterowca Hindenburg. Powodem, dla którego ostatecznie zdecydowano się napełnić sterowiec wodorem był fakt, że w 1927 roku rząd amerykański zabronił eksportu helu (Helium Control Act) odcinając niemieckich konstruktorów od jedynego wówczas źródła tego gazu[63]. Hindenburg eksplodował 6 maja 1937, podchodząc do lądowania w Lakehurst, w stanie New Jersey. Istnieje wiele teorii dotyczących powodu eksplozji. Najbardziej prawdopodobnym powodem jest iskra elektrostatyczna, od której zapalił się wyciekający wodór[63]. Katastrofa Hindenburga wyznacza koniec ery statków powietrznych unoszonych wodorem.
Paliwo
Wodór, ze względu na swoje naturalne właściwości fizyko-chemiczne, świetnie nadaje się na paliwo. Ma najwyższą z paliw, w odniesieniu do masy, wartość opałową (120 MJ/kg[64]) i ciepło spalania (141,9 MJ/kg[64]). Ze względu na bardzo małą gęstość, wodór słabo wypada na tle innych paliw jeżeli wartości te zostaną odniesione do objętości. Jest gazem niebezpiecznym ze względu na szerokie spektrum palności (w mieszaninie z powietrzem) oraz bardzo niskiej energii zapłonu.
Jako paliwo konwencjonalne stosowany jest głównie w rakietach. W przemyśle samochodowym dominują silniki oparte na ogniwach paliwowych[64].
Termin „ekonomia wodoru”, który odnosi się do ekonomicznych aspektów stosowania wodoru jako źródła energii, został po raz pierwszy użyty podczas dyskusji w General Motors w 1970 roku[65]. Został on spopularyzowany na przełomie XX i XXI wieku, gdy prace nad wykorzystaniem wodoru jako źródła energii przybrały na sile, kiedy szereg państw włączył się w rozwój technologii mających na celu ograniczenie emisji dwutlenku węgla. Do działań tych państwa zobowiązały się na konferencji w Kioto w 1997 roku.
Chłodziwo
Wodór może być również wykorzystywany jako medium chłodzące. Wykorzystuje się go szczególnie tam, gdzie konieczne jest ochładzanie gazem. Sprzyjają temu właściwości fizyko-chemiczne tego gazu. Wodór ma bardzo małą gęstość i nawet przy dużych prędkościach przepływ jest laminarny. Ponadto ma wysoki współczynnik przewodzenia (co powoduje, że szybciej odbiera ciepło) oraz ciepło właściwe (skutkiem czego jest duża ilość ciepła, jaką może zakumulować). Przykładem zastosowania wodoru w tym charakterze są turbogeneratory stosowane w elektrowniach. We współczesnych konstrukcjach turbogeneratorów najczęściej stosuje się chłodzenie powietrzne pośrednie w obiegu zamkniętym. Popularne jest również stosowanie bezpośredniego chłodzenia wodorowego uzwojeń wirnika i pośrednie chłodzenie wodorowe uzwojeń stojana[66].
Ze względu na bardzo niską temperaturę skraplania, stosowalność tego typu rozwiązań nie ogranicza się do przedziałów temperaturowych spotykanych zwykle w przemyśle. Możliwe jest również chłodzenie wodorem w skrajnie niskich temperaturach, gdzie obniżenie temperatury jest możliwe jedynie dzięki rozprężaniu gazów.
Zastosowanie cięższych izotopów wodoru
Izotop wodoru – tryt – wykorzystywany jest w badaniach reakcji termojądrowych, które mogą potencjalnie stanowić źródło taniej i czystej energii. Inny jego izotop – deuter – wykorzystywany jest jako spowalniacz (moderator) w reaktorach atomowych neutronów. Związki zawierające deuter są wykorzystywane do przygotowania próbek NMR ze względu na właściwości fizykochemiczne tego atomu.
Formy wodoru
Wodór atomowy
Wodór atomowy to odmiana tworzona przez pojedyncze atomy, w przeciwieństwie do wodoru cząsteczkowego. Wodór atomowy jest nietrwały i szybko łączy się z drugim atomem wodoru, tworząc cząsteczkę H2, czyli wodór cząsteczkowy (molekularny). Wodór atomowy powstaje w wyniku dysocjacji wodoru cząsteczkowego w wysokiej temperaturze i jest znacznie bardziej aktywny chemicznie niż wodór molekularny.
Wodór atomowy powszechnie występuje w przestrzeni międzygwiazdowej[14].
Wodór cząsteczkowy
Wodór cząsteczkowy (wodór dwuatomowy, wodór molekularny) (H2) to najprostsza dwuatomowa cząsteczka homoatomowa. Składa się z dwóch atomów wodoru połączonych wiązaniem kowalencyjnym o długości 74,14 pm (0,7414 Å) i o energii dysocjacji 435,88 kJ/mol (25 °C)[67].
Na Ziemi wodór w postaci cząsteczkowej występuje w atmosferze – przy powierzchni w ilościach śladowych (ok. 0,5 ppm obj.), natomiast w wysokich, bardzo rozrzedzonych warstwach jest składnikiem dominującym[68].
Ortowodór i parawodór
Jak wszystkie dwuatomowe cząsteczki homojądrowe o niezerowym spinie jąder, wodór występuje w dwóch odmianach spinowych o nieco innych właściwościach fizycznych (np. o różnym cieple właściwym) znanych jako ortowodór i parawodór. Różnią się one wzajemną orientacją spinów protonów. W ortowodorze spiny skierowane są zgodnie, zaś w parawodorze – przeciwnie. Naturalny wodór molekularny w temperaturze pokojowej i wyższej stanowi mieszaninę obu odmian (ok. 75% ortowodoru i 25% parawodoru, czyli w stosunku 3:1)[67], natomiast w temperaturze obniżonej udział parawodoru wzrasta, osiągając 99,8% w temperaturze −253 °C[67][69]. Podobnie zachowuje się orto- i paratryt, natomiast dla orto- i paradeuteru sytuacja jest odwrotna[67].
Przemiana ortowodoru w parawodór jest egzotermiczna, lecz wymaga udziału zabronionego przejścia tryplet-singlet[67]. W normalnych warunkach jest ona wolna i poniżej temperatury 500 °C układ o:p = 3:1 jest stanem metastabilnym[70]. Proces przemiany jest katalizowany przez substancje paramagnetyczne[67].
Wodór metaliczny
Metaliczny wodór to stan, który wodór uzyskuje pod ciśnieniem 495 gigapaskali i w temperaturze 5,5 kelwina. Stan ten wykazuje dobre przewodnictwo elektryczne i inne właściwości metaliczne[71].
Kation wodorowy
Kation wodorowy H+
jest w istocie równoważny protonowi. W stanie wolnym występuje on w próżni, plazmie i górnych warstwach atmosfery ziemskiej (promienie UV jonizują atomy wodoru). W roztworach wodnych kation ten ulega silnej hydratacji:
- H+
+ H
2O → H
3O+
Kation hydroniowy (hydroksoniowy) H
3O+
rzeczywiście istnieje w niektórych związkach w warunkach bezwodnych. W roztworze wodnym grupa ta jest dalej hydratowana przez kolejne cząsteczki wody. Wśród modeli solwatacji H
3O+
wyróżnić można kation Zundela H
5O+
2 i kation Eigena H
9O+
4. Pomiary kriometryczne wskazują, że hydratowany jon ma przeciętnie wielkość odpowiadającą [H
3O(H
2O)
6]+
[72].
Serie widmowe
Wodór ma charakterystyczne serie widmowe:
- seria Lymana
- seria Balmera
- seria Paschena
- seria Bracketta
- seria Pfunda
- seria Humphreysa
Otrzymywanie
Na skalę przemysłową wodór otrzymuje się następującymi metodami:
- CxH
2y + 2xH
2O →(2x+y)H
2 + xCO
2- CH
4 + 2H
2O → 4H
2 + CO
2 - CH
- Przez reakcję pary wodnej z koksem w reakcji Boscha:
- C + H
2O → CO + H
2
- Termiczny rozpad CH
4:
- 2CH
4 _2000 °C_͕ C
2H
2 + 3H
2
- Reakcje metanu z tlenem:
- 2CH
4 + O
2 → 2CO + 4H
2
W laboratorium można go otrzymać na kilka sposobów:
- Elektroliza wodnego roztworu soli lub wodorotlenku metalu alkalicznego bądź wody:
- 2H
2O → 2H
2 + O
2
- Reakcja metalu z kwasem:
- np. Zn + 2HCl → ZnCl
2 + H
2↑
- Spalanie magnezu w parze wodnej:
- Mg + H
2O → MgO + H
2↑
- Reakcja metalu amfoterycznego z roztworem zasady:
np. 2Al + 2NaOH + 6H
2O → 2Na[Al(OH)
4] + 3H
2↑
- Reakcja otrzymywania wodorotlenku dobrze rozpuszczającego się w wodzie przez połączenie metalu aktywnego z wodą:
np. 2K + 2H
2O → 2H
2O−KOH + H
2↑
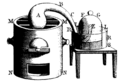
Powyższe reakcje roztwarzania metali wykonywać można dogodnie w aparacie Kippa.
Izotopy wodoru
Znane są 3 naturalnie występujące izotopy wodoru:
- prot (wodór 1
H)
- W skład jądra wchodzi jeden proton. Nie zawiera neutronów. Jest izotopem stabilnym. Stanowi 99,985% wodoru występującego na Ziemi.
- deuter (2
H lub D)
- W skład jądra wchodzi jeden proton i jeden neutron. Jest izotopem stabilnym. Stanowi 0,015% wodoru ziemskiego. Ze względu na to, że deuter ma dwukrotnie większą masę od protu, różnią się one znacząco właściwościami fizycznymi i chemicznymi (silny efekt izotopowy).
- tryt (3
H lub T)
- W skład jądra wchodzi jeden proton i dwa neutrony. Jest izotopem niestabilnym o czasie połowicznego rozpadu wynoszącym ok. 12 lat. Na Ziemi występuje w ilościach śladowych. Ulega rozpadowi β− z powstaniem helu-3:
- 31H → 32He + e- + νe
- W skład jądra wchodzi jeden proton i dwa neutrony. Jest izotopem niestabilnym o czasie połowicznego rozpadu wynoszącym ok. 12 lat. Na Ziemi występuje w ilościach śladowych. Ulega rozpadowi β− z powstaniem helu-3:
Sztucznie wytworzono cięższe izotopy wodoru, zawierające 3–6 neutronów. Wszystkie one są bardzo nietrwałe, ich czas połowicznego rozpadu jest rzędu 10−22–10−23 s.
Związki wodoru
- wodorki
- tlenki wodoru
- wodorotlenki
- kwasy (poza kwasami Lewisa)
- prawie wszystkie związki organiczne
Zobacz też
- antywodór
- biowodór
- ciekły wodór
- przechowywanie wodoru
- promień atomu Bohra
- linia wodoru 21 cm
- obszar H I
- biekscyton
- choroba wodorowa miedzi
Uwagi
- ↑ Podana wartość stanowi przybliżoną standardową względną masę atomową (ang. abridged standard atomic weight) publikowaną wraz ze standardową względną masą atomową, która wynosi [1,00784; 1,00811]. Z uwagi na zmienność abundancji izotopów pierwiastka w naturze, wartości w nawiasach klamrowych stanowią zakres wartości względnej masy atomowej dla naturalnych źródeł tego pierwiastka. W dostępnych komercyjnie produktach mogą występować znaczne odchylenia masy atomowej od podanej, z uwagi na zmianę składu izotopowego w rezultacie nieznanego bądź niezamierzonego frakcjonowania izotopowego.
- ↑ Tł. „Nowe eksperymenty dotyczące związku pomiędzy płomieniem a powietrzem”.
- ↑ Mars był terminem używanym na określenie żelaza.
Przypisy
- ↑ a b c David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 4-66, ISBN 978-1-4200-9084-0 (ang.).
- ↑ David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 6-52, ISBN 978-1-4200-9084-0 (ang.).
- ↑ hydrogen (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-03-27].
- ↑ Wodór (nr 00473) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Stanów Zjednoczonych. [dostęp 2011-09-29]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b Wodór (nr 00473) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2011-09-29]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Thomas Prohaska i inni, Standard atomic weights of the elements 2021 (IUPAC Technical Report), „Pure and Applied Chemistry”, 94 (5), 2021, s. 573–600, DOI: 10.1515/pac-2019-0603 (ang.).
- ↑ David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 4-133, ISBN 978-1-4200-9084-0 (ang.).
- ↑ Wartość dla ciała stałego wg: Charles N. Singman, Atomic volume and allotropy of the elements, „Journal of Chemical Education”, 61 (2), 1984, s. 137–142, DOI: 10.1021/ed061p137 (ang.).
- ↑ Wodór, [w:] Encyklopedia PWN [online] [dostęp 2021-07-30].
- ↑ G.W.C. Kaye, T.H. Laby: Tables of Physical & Chemical Constants (16th Edition 1995) 3.1.3 Abundances of the elements. The National Physical Laboratory, 1995. (ang.).
- ↑ a b David N. Schramm: The Big Bang and Other Explosions in Nuclear and Particle Astrophysics. World Scientific Publishing Co. Pte. Ltd., 1996. ISBN 981-02-2024-3. (ang.).
- ↑ Viatcheslav Mukhanov: Physical Foundations of Cosmology. Cambridge University Press, 2005. ISBN 978-0-521-56398-7. (ang.).
- ↑ Stephen Hawking, Leonard Mlodinov: A Briefer History of Time. Transworld Publishers, 2008. ISBN 978-0-593-05697-4. (ang.).
- ↑ a b Hubert Reeves i inni, On the Origin of Light Elements, „The Astrophysical Journal”, 179, 1973, s. 909, DOI: 10.1086/151928 (ang.).
- ↑ Hubert Reeves, On the Origin of the Light Elements, „Annual Review of Astronomy and Astrophysics”, 12 (1), 1974, s. 437–470, DOI: 10.1146/annurev.aa.12.090174.002253 (ang.).
- ↑ Dina Prialnik: An Introduction to the Theory of Stellar Structure and Evolution. Cambridge University Press, 2000. ISBN 052165937-X. (ang.).
- ↑ a b P.Litherland Teed: The Cheistry and Manufacture of Hyrogen. New York: Longmans, Green and Co., 1919. (ang.).
- ↑ Paracelsus: Archidoxa Philippi Theophrasti Bombast Paracelsi Magni, De Separationibus Elementorum. Strasburg: 1574, s. 64.
- ↑ Leonard Dobbin, Paracelsus and the discovery of hydrogen, „Journal of Chemical Education”, 9 (6), 1932, s. 1122, DOI: 10.1021/ed009p1122 (ang.).
- ↑ Théodore Turquet de Mayerne: Opera medica, complectentia consilia, epistolas et observationes, pharmacopeam, variasque medicamentorum formulas. Londyn: 1700.
- ↑ Robert Boyle: Tracts containing new experiments touching the relation betwixt flame and air. 1672.
- ↑ Henry Cavendish: Three Papers, containing Experiments on factitous Air, by the Hon. Henry Cavendish, F.R.S.. 1766.
- ↑ Jan Golinski: Precision instruments and the demonstrative order of proof in Lavoisier’s chemistry. Osiris, 1994, s. 30-47.
- ↑ Jan Śniadecki: Żywoty uczonych Polaków. Kraków: Wydanie Kazimierza Józefa Turowskiego, 1861.
- ↑ Władysław Leppert. Materyały do historyi chemii w Polsce. „Chemik Polski”. X (14-16). s. 341-354.
- ↑ Jędrzej Śniadecki: Początki Chemii. Wilno: 1800, s. 93-102.
- ↑ Sprawozdania z czynności i posiedzeń, wyd. Kraków, Akademia Umiejętności, 1902, s. 19.
- ↑ Redakcya „Chemika Polskiego”: Słowniczek Chemiczny. Warszawa: Chemik Polski, 1902.
- ↑ Zygmunt Wróblewski, Die Zusammendrückbarkeit des Wasserstoffes, t. 97, Ak. d. Wiss. Wien, 1888, s. 1321 (niem.).
- ↑ a b Karol Olszewski, Skraplanie gazów - szkic historyczny, 1908, s. 119-141.
- ↑ Karol Olszewski, Essais de liquefaction de l'hydrogene, t. 98, Acad. Sci. Paris, 1884, s. 365-366 (fr.).
- ↑ Karol Olszewski, Nouveaux essais de liquefaction de l'hydrogene. Solidification et pression critique de l'azote, t. 98, Acad. Sci. Paris, 1884, s. 913-915 (fr.).
- ↑ Karol Olszewski, Oznaczenie temperatury krytycznej i temperatury wrzenia wodoru, Akademia Krakowska, 1895, s. 404-412.
- ↑ Karol Olszewski, Über den kritischen Druck des Wasserstoffes, Akademia Krakowska, 1891, s. 192 (niem.).
- ↑ Karol Olszewski, Bestimmung der kritischen und Siedetemperatur des Wasserstoffes, t. 192, Akademia Krakowska, 1895 (niem.).
- ↑ Karol Olszewski, Bestimmung der Inversionstemperatur der Kelvinischer Erscheinung für Wasserstoff, t. 453, Akademia Krakowska, 1901.
- ↑ Karol Olszewski, Apparate zur Verflüssigung von Luft und Wasserstoff, t. 619, Akademia Krakowska, 1902 (niem.).
- ↑ Karol Olszewski, Ein neuer Apparat zur Verflüssigung des Wasserstoffes, t. 241, Akademia Krakowska, 1903 (niem.).
- ↑ James Dewar. Application of Liquid Hydrogen to the Production of High Vacua. „Proc.Roy.Soc.”. 64, s. 231-238, 1898. (ang.).
- ↑ James Dewar. Liquid Hydrogen. „Proc. Roy. Inst.”. 16, s. 1-14, 1899.
- ↑ James Dewar. Liquid Hydrogen. „Proc. Roy. Inst.”. 16, s. 212-217, 1899.
- ↑ James Dewar. Solidification of Hydrogen. „Brit. Assoc.”. 69, s. 683, 1899.
- ↑ James Dewar. Solid Hydrogen. „Proc.Roy.Inst.”. 16, s. 473-480, 1900. (ang.).
- ↑ Douglas Considiene: Van Nostrand"s Scientific Encyclopedia. New York: Springer Science+Business Media, 1995, s. 931, 1637. ISBN 978-1-4757-6920-3.
- ↑ a b c d Peter Häussinger, Reiner Lohmüller, Allan M. Watson, Hydrogen - 6. Uses, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, DOI: 10.1002/14356007.o13_o07 (ang.).
- ↑ Nawozy azotowe, Azoty Tarnów [zarchiwizowane z adresu 2016-03-18].
- ↑ Rozporządzenie Parlamentu Europejskiego i Rady (WE) nr 1333/2008 z dnia 16 grudnia 2008 r.. 2008. [dostęp 2016-06-14].
- ↑ Rozporządzenie Komisji (UE) NR 1129/2011 z dnia 11 listopada 2011 r.. 2011. [dostęp 2016-06-14].
- ↑ Sławomir Neumann: Odpowiedź na interpelację nr 31709 w sprawie szkodliwego wpływu sztucznych barwników spożywczych. 25.05.2015. [dostęp 2016-06-14].
- ↑ Rozporządzenie ministra zdrowia z dnia 22 listopada 2010 r.. 2010. [dostęp 2016-06-14].
- ↑ Dyrektywa Komisji 2010/67/UE z dnia 20 października 2010 r.. 21.10.2010. s. 23. [dostęp 2016-06-14].
- ↑ Dyrektywa Komisji 2008/84/WE z dnia 27 sierpnia 2008 r.. 20.09.2008. s. 159. [dostęp 2016-06-14].
- ↑ Ian P. Freeman, Margarines and Shortenings, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, DOI: 10.1002/14356007.a16_145 (ang.).
- ↑ Adam Stanisław Koss. Wodór, jego fabrykacya i zastosowania. „Przegląd Techniczny”. 51,52, s. 472-473, 27.12.2016.
- ↑ Portal wiedzy WIEM - Utwardzanie tłuszczów ciekłych. [dostęp 2016-06-14]. [zarchiwizowane z tego adresu (2016-08-07)].
- ↑ Andrzej Łędzki: Metalurgia ekstrakcyjna żelaza. Kraków: Akademia Górniczo-Hutnicza, s. 33.
- ↑ a b Piers Letcher: Eccentric France: The Bradt Guide to Mad, Magical and Marvellous France. Buckinghamshire, England: Bradt Travel Guides, 2003, s. 35-36. ISBN 978-1-84162-068-8.
- ↑ a b c d e f Ballooning. W: Jeffrey H. Williams: Order from Force: A Natural History of the Vacuum. Bristol, UK: Morgan & Claypool Publishers, 2015. ISBN 978-1-68174-049-2.
- ↑ a b Dr. William B. Ashworth Jr.: Scientist of the Day - Jacques-Alexandre Charles. 2014-11-14. [dostęp 2016-05-28].
- ↑ a b c G. Pfotzer, History of the use of balloons in scientific experiments, „Space Science Reviews”, 13 (2), 1972, DOI: 10.1007/BF00175313 (ang.).
Wersja dostępna bezpłatnie [dostęp 2020-03-27]. - ↑ Tim Sharp: The First Hot-Air Balloon - The Greatest Moments in Flight. 2012-06-16. [dostęp 2016-05-28].
- ↑ Hydrogen Airship Disasters. [dostęp 2016-05-29].
- ↑ a b Steven Ruffin: Flights of No Return: Aviation History's Most Infamous One-Way Tickets to Immortality. Zenith Press, 2015, s. 46-50. ISBN 978-0-7603-4792-8.
- ↑ a b c David Rand: Hydrogen Energy - Challenges and Prospects. RSC Publishing, 2008. ISBN 978-0-85404-597-6. (ang.).
- ↑ Lawrence W. Jones. Toward a liquid hydrogen fuel economy. „University of Michigan Engineering Technical Report UMR2320”, 13 marca 1970. (ang.).
- ↑ Nancy Spring, Hydrogen Cools Well, but Safety is Crucial, 6 stycznia 2009 [dostęp 2020-03-06] [zarchiwizowane z adresu 2017-10-08] (ang.).
- ↑ a b c d e f N. N. Greenwood, A. Earnshaw: Chemistry of the elements. Oxford; New York: Pergamon Press, 1984, s. 41–42. ISBN 0-08-022057-6.
- ↑ Adam Bielański: Podstawy chemii nieorganicznej. Wyd. 5. Warszawa: PWN, 2002, s. 529. ISBN 83-01-13654-5.
- ↑ Encyclopedia Astronautica: Liquid Air/LH2. [dostęp 2013-02-27]. (ang.).
- ↑ Sidney W. Benson: The Foundations of Chemical Kinetics. New York – Toronto – London: McGraw-Hill Book Company, Inc., 1960, s. 106, seria: McGraw-Hill Series in Advanced Chemistry. (ang.).
- ↑ Piotr Cieśliński, Fizycy z Harvardu uzyskali metaliczny wodór. Ten bajeczny materiał może zmienić XXI wiek, wyborcza.pl, 26 stycznia 2017 [dostęp 2018-01-22].
- ↑ Andreas A. Zavitsas, Properties of Water Solutions of Electrolytes and Nonelectrolytes, „The Journal of Physical Chemistry B”, 105 (32), 2001, s. 7805–7817, DOI: 10.1021/jp011053l (ang.).
Bibliografia
- Ignacy Eichstaedt: Księga pierwiastków. Warszawa: 1973.
| Układ okresowy pierwiastków | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3[i] | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||||
| 8 | Uue | Ubn | ✱ | |||||||||||||||||||||||||||||||||||||||||
| ✱ | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | ...[ii] | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for gas bottles
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Departure of Jacques Charles and Marie-Noel Robert’s ‘aerostatic globe’ balloon from the Jardin des Tuileries, Paris, on Dec. 1, 1783.
Drawing shows Jacques Charles and Nicolas Marie-Noel Robert standing in their hydrogen-filled balloon waving flags, beginning their ascent from the Tuileries Gardens, Paris, with the former Tuileries Palace in the background. Thousands of spectators are gathered in the foreground to witness the first manned gas balloon flight.
"Anonymous engraving on the same lines, with print entitled 'To the honour of Messrs. Charls and Robert'"—typed on accompanying note.H2 spectra using a 600lpm diffraction grating.
Autor: Original PNGs by Daniel Mayer, traced in Inkscape by User:Stannered, Licencja: CC-BY-SA-3.0
Hexagonal crystal structure
Zeppelin the Hindenburg on fire at the mooring mast of Lakehurst (United States of America) 6 May 1937. Ballast water is thrown down. Exit airships.
synthesis of D-sorbitol (2) reducing D-glucose (1) or L-gulose (3)
Uploaded from Eckermann, Erik (2001). World history of the automobile. SAE. pp. 18 - 19. ISBN 076800800X. https://books.google.com/books?id=yLZeQwqNmdgC&pg=PA18&dq=fran%C3%A7ois+isaac+de+rivaz+engine&hl=en&ei=jVG9TdG2Hsy38gPv1eC2BQ&sa=X&oi=book_result&ct=result&resnum=5&ved=0CD4Q6AEwBA#v=onepage&q&f=false.
Hydrogen atom
Antoine-Laurent Lavoisier. Line engraving by Louis Jean Desire Delaistre, after a design by Julien Leopold Boilly. Modific. version 2.
Jędrzej Śniadecki
(c) North Carolina School of Science and Mathematics, CC BY 3.0
Analyzing the wavelengths and intensity of hydrogen, neon and helium gas atoms with the spectrophotometer.
NCSSM, a publicly funded high school in North Carolina, provides exciting, high-level STEM learning opportunities. If you appreciate this video, please consider making a tax-deductible donation to the NCSSM Foundation. Thank you! https://connections.ncssm.edu/giving
Please attribute this work as being created by the North Carolina School of Science and Mathematics. This work is licensed under creative commons CC-BY https://creativecommons.org/licenses/by/3.0/
Help us caption & translate this video!
http://amara.org/v/GAbn/Chemical diagram showing the reduction of nitrobenzene with tin dichloride (SnCl2) to give aniline
(c) Bundesarchiv, Bild 183-R68085 / CC-BY-SA 3.0
Illus-Bittner Die Versorgung Berlins. 2.2.48 Bei der Märkischen Margarine-Fabrik. Eine der im Betrieb befindlichen 3 Packmaschinen, mit der pro Stunde 30 Ztr. Margarine zur Verpackung kommen.
1122-48Autor: Alchemist-hp (talk) (www.pse-mendelejew.de), Licencja: FAL
Spectrum = gas discharge tube filled with hydrogen H2. Used with 1,8kV, 18mA, 35kHz. ≈8" length.
Hand sketch engraving made by madamme Lavoisier in the 18th century featured in "Traité élémentaire de chimie" retrieved from http://mattson.creighton.edu/History_Gas_Chemistry/Lavoisier.html Lavoisier performed his classic twelve-day experiment in 1779 which has become famous in history. First, Lavoisier heated pure mercury in a swan-necked retort over a charcoal furnace for twelve days. A red oxide of mercury was formed on the surface of the mercury in the retort. When no more red powder was formed, Lavoisier noticed that about one-fifth of the air had been used up and that the remaining gas did not support life or burning. Lavoisier called this latter gas azote. (Greek 'a' and ' zoe' = without life). He removed the red oxide of mercury carefully and heated it in a similar retort. He obtained exactly the same volume of gas as disappeared in the last experiment. He found that the gas caused flames to burn brilliantly, and small animals were active in it as Joseph Priestley had noticed in his experiment. Finally, on mixing the two types of gas, i.e. the gas left in the first experiment, and that given out in the second experiment, he got a mixture similar to air in all respects. In his experiments Lavoisier analysed air into two constituents: the one which supports life and combustion, and is one-fifth by volume of air he called oxygen (Greek, oxus=acid, gen=beget), the other four-fifths which does not he called azote. This latter gas is now called nitrogen. From the two gases he synthesised something that has the characteristics of air.
This is a Hubble Space Telescope image (right) of a vast nebula called NGC 604, which lies in the neighboring spiral galaxy M33, located 2.7 million light-years away in the constellation Triangulum.
This is a site where new stars are being born in a spiral arm of the galaxy. Though such nebulae are common in galaxies, this one is particularly large, nearly 1,500 light-years across. The nebula is so vast it is easily seen in ground-based telescopic images (left).
At the heart of NGC 604 are over 200 hot stars, much more massive than our Sun (15 to 60 solar masses). They heat the gaseous walls of the nebula making the gas fluoresce. Their light also highlights the nebula's three-dimensional shape, like a lantern in a cavern. By studying the physical structure of a giant nebula, astronomers may determine how clusters of massive stars affect the evolution of the interstellar medium of the galaxy.
The nebula also yields clues to its star formation history and will improve understanding of the starburst process when a galaxy undergoes a "firestorm" of star formation. The image was taken on January 17, 1995 with Hubble's Wide Field and Planetary Camera 2. Separate exposures were taken in different colors of light to study the physical properties of the hot gas (17,000 degrees Fahrenheit, 10,000 degrees Kelvin