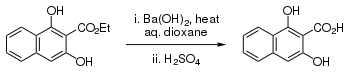Wodorotlenek baru
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | Ba(OH)2 | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 171,34 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | białe ciało stałe | ||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||
| Inne aniony | |||||||||||||||||||||||||||||||||||||||||||||||||
| Inne kationy | |||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||
Wodorotlenek baru Ba(OH)2 – nieorganiczny związek chemiczny. Roztwór wodorotlenku baru jest silną zasadą, w stanie stałym występuje w postaci białych granulek lub proszku.
Otrzymywanie
Wodorotlenek baru otrzymywany jest w wyniku reakcji tlenku baru (BaO) z wodą. Krystalizuje jako ośmiowodny hydrat (Ba(OH)2·8H2O), który może zostać odwodniony do związku jednowodnego (monohydratu) poprzez ogrzewanie na powietrzu lub odwodniony całkowicie podczas ogrzewania w 100 °C pod próżnią.
Zastosowanie
Wodorotlenek baru jest używany w chemii analitycznej do miareczkowania słabych kwasów, zwykle kwasów organicznych. Jest „czystym odczynnikiem” wolnym od zanieczyszczeń wodorotlenku sodu i wodorotlenku potasu. Rozpuszczony nie zawiera niepożądanych węglanów (węglan baru jest nierozpuszczalny w wodzie). Używany do miareczkowania z takimi wskaźnikami jak fenoloftaleina lub tymoloftaleina zmieniających kolor w środowisku alkalicznym, bez ryzyka błędu miareczkowania spowodowanego słabymi jonami węglanowymi. Wodny nasycony roztwór wodorotlenku baru nazywany jest wodą barytową.
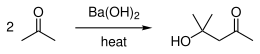
Wodorotlenek baru używany jest w syntezie organicznej jako silna zasada, np.
- do syntezy cyklopentanonu[4]:
- do syntezy alkoholu diacetonowego[5]:
oraz w innych reakcjach.
Inne zastosowania
- do neutralizacji rozlanych kwasów
- składnik preparatów homeopatycznych
Zagrożenia
Wodorotlenek baru jest żrący i szkodliwy dla zdrowia.
Przypisy
- ↑ a b c Wodorotlenek baru (nr 433373) w katalogu produktów Sigma-Aldrich (Merck KGaA). [dostęp 2011-01-16].
- ↑
 Karl Meyer, Henry S. Bloch. Naphthoresorcinol. „Org. Synth.”. 25, s. 73, 1945. DOI: 10.15227/orgsyn.025.0073.
Karl Meyer, Henry S. Bloch. Naphthoresorcinol. „Org. Synth.”. 25, s. 73, 1945. DOI: 10.15227/orgsyn.025.0073. - ↑
 George Bosworth Brown. Methylsuccinic acid. „Org. Synth.”. 26, s. 45, 1946. DOI: 10.15227/orgsyn.026.0054.
George Bosworth Brown. Methylsuccinic acid. „Org. Synth.”. 26, s. 45, 1946. DOI: 10.15227/orgsyn.026.0054. - ↑
 J. F. Thorpe, G. A. R. Kon. Cyclopentanone. „Org. Synth.”. 5, s. 37, 1925. DOI: 10.15227/orgsyn.005.0037.
J. F. Thorpe, G. A. R. Kon. Cyclopentanone. „Org. Synth.”. 5, s. 37, 1925. DOI: 10.15227/orgsyn.005.0037. - ↑
 J. B. Conant, Niel Tuttle. Diacetone alcohol. „Org. Synth.”. 1, s. 45, 1921. DOI: 10.15227/orgsyn.001.0045.
J. B. Conant, Niel Tuttle. Diacetone alcohol. „Org. Synth.”. 1, s. 45, 1921. DOI: 10.15227/orgsyn.001.0045.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Autor: Autor nie został podany w rozpoznawalny automatycznie sposób. Założono, że to Physchim62 (w oparciu o szablon praw autorskich)., Licencja: CC BY 2.5
Description: Preparation of cyclopentanone. For details see Thorpe, J. F.; Kon, G. A. R. "Cyclopentanone". Org. Synth. 5:37; Coll. Vol. 1:192.
- Author, date of creation: selfmade by Physchim62 on 2005-11-27.
- Source: user-created image
- Copyright: GNU Free Documentation License. (GFDL)
- Comments: high-resolution b/w PNG; ChemSketch / Paint shop.
Reaction scheme of barium hydroxide-catalyzed 2-carboxy-1,3-dihydroxynaphthalene preparation.
The hazard symbol for corrosive substances according to directive 67/548/EWG by the European Chemicals Bureau, now known as the Consumer Products Safety and Quality (CPS&Q) Unit.
Reaction scheme of barium hydroxide-catalyzed hydrolysis of a nitrile.
Reaction scheme of barium hydroxide-catalyzed condensation of acetone.