Zatoczek rogowy
| Planorbarius corneus | |||
| (Linnaeus, 1758) | |||
 Zatoczek rogowy (Planorbarius corneus) – osobnik albinotyczny. | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Gromada | |||
| (bez rangi) | Heterobranchia | ||
| (bez rangi) | Euthyneura | ||
| (bez rangi) | Panpulmonata | ||
| (bez rangi) | Hygrophila | ||
| Nadrodzina | Planorboidea | ||
| Rodzina | |||
| Rodzaj | |||
| Gatunek | zatoczek rogowy | ||
| Synonimy | |||
| |||
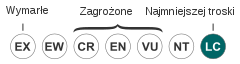
| Kategoria zagrożenia (CKGZ)[1] | |||
 | |||
Zatoczek rogowy (Planorbarius corneus) – gatunek słodkowodnego ślimaka z rodziny zatoczkowatych (Planorbidae), szeroko rozprzestrzeniony w Palearktyce. Największy przedstawiciel rodziny występujący w Polsce, jeden z najpospolitszych i największych ślimaków występujących w Polsce. Gatunek eurytopowy, polimorficzny, o dużej odporności na wysychanie, niewrażliwy na eutrofizację wód i fluktuacje warunków środowiskowych. Obojnak zdolny do samozapłodnienia, składający jaja w kokonach jajowych o charakterystycznej budowie. Jest żywicielem pośrednim wielu gatunków pasożytniczych przywr. Stanowi pokarm wielu bezkręgowców i kręgowców wodnych. Gatunek popularny wśród akwarystów.
Systematyka
Zatoczek rogowy należy do rodziny zatoczkowatych. Po raz pierwszy opisany został przez Linneusza jako Helix cornea[2]. Ze względu na duży polimorfizm morfologii ślimaków tego gatunku niektórzy taksonomowie przypisują sympatrycznie występującym odmianom status osobnych gatunków, które grupują w kompleksie gatunków P. corneus sensu lato. Kompleks ten obejmować ma m.in. P. corneus (L.) (sensu stricto), P. banaticus (Lang, 1856), P. purpura (O.F. Muller, 1774), P. grandis (Dunker, 1856), P. stenosoma (Bourguignat in Srvain, 1881). Status tak wyróżnionych gatunków jest jednak niepewny. Okazało się bowiem, że kariotypy ich przedstawicieli nie różnią się od siebie i od kariotypu P. corneus, co stawia pod znakiem zapytania sensowność wyróżniania tych gatunków[3]. Jednocześnie stwierdzono, że populacje zatoczka rogowego zasiedlające odległe od siebie zbiorniki wodne różnią się pod względem markerów allozymatycznych i cech kariotypowych, co może być przesłanką dla wyróżnienia nowych taksonów w obrębie kompleksu gatunków P. corneus sensu lato[3][4].
Etymologia nazwy
Nazwa rodzaju odnosi się do kształtu muszli (planus łac. – równy, płaski, orbis – koło, krąg[5]), epitet gatunkowy – do barwy muszli (corneus łac. – rogowy).
Podgatunki
Wyróżniono kilka podgatunków i form morfologicznych[1]:
- Planorbarius corneus corneus (Linnaeus, 1758) – podgatunek nominatywny
- Planorbarius corneus arabatzis (Reischütz, Reischütz & Fischer 2008)
- Planorbarius corneus grandis (Dunker, 1850) – występuje w jeziorach leżących u północno-wschodnich wybrzeży Morza Czarnego[6]
- P. corneus f. ammonoceras Wester – muszla stosunkowo mała (wysokość do 9 mm, szerokość do 25 mm) z sześcioma skrętami, przypłaszczona. Występuje w drobnych zbiornikach leśnych, torfiankach[7].
- P. corneus f. pinguis Wester – muszla gruba, bardzo duża (szerokość do 40 mm, wysokość 15 mm i więcej), z 4½-5 skrętów, przy czym ostatni jest silnie rozszerzony, a wysokość otworu jest większa niż szerokość. Występuje w jeziorach i stawach[7].
Cechy morfologiczne
Muszla duża, płasko zwinięta (planispiralna), lewoskrętna, zbudowana z 5-6 skrętów[8]. Skręty obłe, pozbawione krawędzi, szybko narastające. Ostatni dwa razy szerszy od przedostatniego. Górna strona muszli zagłębiona, skręty embrionalne leżą na dnie uformowanego przez to zagłębienie lejka. Strona dolna muszli tylko nieznacznie wklęsła. Otwór muszli ma kształt nerkowaty, jego brzegi nie są połączone ze sobą. Krawędzie otworu ostre, bez wargi. Brzeg otworu w części górnej wybiega nieco ku przodowi. Muszla grubościenna, barwy czerwonobrunatnej lub oliwkowobrązowej, z matowym połyskiem – strona dolna zwykle jaśniejsza. Na zewnętrznej powierzchni muszli nieregularne poprzeczne i spiralne prążki, dające efekt „młotkowania”. Muszle młodych ślimaków z regularnym prążkowaniem, pokryte szczecinkami. Szerokość muszli: do 20-40 mm; wysokość: do 8-16 mm[9][10]. Ciało szaroczarne lub brązowawe, u młodych osobników czerwonawe. Czasami występują osobniki albinotyczne – o ciele barwy czerwonej, wskutek przeświecającej przez okrywy ciała krwi, która zawiera hemoglobinę. Stopa szeroka, z przodu zaokrąglona, z tyłu zaostrzona. Głowa wydłużona, z szerokimi płatami gębowymi. Czułki nitkowate, rozszerzone u nasady[7].
Występowanie
Występuje w niemal całej kontynentalnej Europie (z wyjątkiem Półwyspu Iberyjskiego[1], na północy sięga do 64°N w Finlandii[8]), na Wyspach Kanaryjskich, Azorach, Maderze oraz w zachodniej i północnej Azji, do dorzecza Obu, w południowej Azji po Iran, Turkmenistan, Turcję[1][6]. W górach występuje do 800 m n.p.m.[8]. W Polsce jest jednym z najpospolitszych i najliczniej występujących ślimaków słodkowodnych, znajdywanym w całym kraju, z wyjątkiem niektórych najwyżej położonych zbiorników i cieków górskich[7][11]. W stawach może osiągać zagęszczenie do 40 osobników/m2[12].
Biologia i ekologia
Zmysły
Zatoczek rogowy posiada parę oczu, osadzonych u podstawy czułków. Oczy mają kształt lekko eliptycznych pęcherzyków, oddzielonych warstwą komórek walcowatych. Można w nich wyróżnić rogówkę, nieruchomą soczewka o sferycznym kształcie i stałej ogniskowej, ciało szkliste oraz jednowarstwową siatkówkę składającą się z pojedynczej warstwy fotoreceptorów i pigmentowych komórek pomocniczych. Siatkówka jest zorientowana prosto w kierunku padania promieni świetlnych (nie jest odwrócona)[13][14]. Struktura siatkówki umożliwia rozróżnianie obiektów z rozdzielczością 1,43-1,91 stopnia[14]. Choć dystans ostrego widzenia nie przekracza kilku centymetrów, wzrok płucodysznych ślimaków wodnych jest uważany za lepszy niż u ich krewniaków lądowych – ślimaki posługują się nim do lokalizacji łodyg makrofitów wynurzonych i pływających, po których wspiąć się mogą do powierzchni wody w celu zaczerpnięcia oddechu[15].
Osobniki tego gatunku wykazują pozytywną fototaksję[14].
W lokalizacji preferowanego pożywienia i unikaniu substancji szkodliwych zatoczek rogowy posługuje się chemorecepcją: w testach preferencji osobniki tego gatunku podążały w kierunku źródła uwalniającego takie związki chemiczne, jak kwas L-asparaginowy, histaminę, karnozynę, L- i D-prolinę, L-tryptofan, D-alaninę, nie reagowały natomiast na L-alaninę (enancjomer D alaniny, w odróżnieniu od enancjomeru L, jest składnikiem peptydoglikanów w ścianie komórkowej bakterii, wchodzących w skład peryfitonu)[16].
Organami zmysłu dotyku są parzyste, niewciągane czułki, okolica otworu gębowego, krawędź nogi, brzeg płaszcza – w tych rejonach ciała zagęszczenie komórek zmysłowych jest szczególnie duże[13]. Zatoczek rogowy może regenerować uszkodzone czułki[17].
W przedniej części nogi, obok zwojów nożnych, znajduje się para statocyst, będących narządem równowagi. Mają one budowę pęcherzykowatą, średnicę 0,1-0,5 mm (zależnie od wielkości osobnika). Zewnętrzną ścianę statocysty stanowi warstwa tkanki łącznej i błona podstawna, wnętrze wyłożone jest urzęsionym nabłonkiem zmysłowym i wypełnione statolimfą[18].
Genetyka
Diploidalny zestaw chromosomów stanowi 18 par chromosomów (2n=36), w tym 30 chromosomów metacentrycznych i 6 chromosomów submetacentrycznych[3][19]. Wielkość chromosomów maleje stopniowo od 1 pary (której długość stanowi 8,42% sumarycznej długości wszystkich chromosomów (TCL)) do 18 pary (3,69% TCL)[3].
Zajmowane siedliska

Gatunek eurytopowy. Występuje w różnych typach wód śródlądowych: rzekach o słabym prądzie, starorzeczach, stawach, jeziorach, torfiankach, oczkach wodnych, zbiornikach śródleśnych i okresowych, głównie w płytkim litoralu. W rzekach najliczniej zasiedla partie o wolnym nurcie, w jeziorach – strefę makrofitów wynurzonych. Związany z roślinnością wodną[20] – najczęściej znajdowany bywa na pałce szerokolistnej (Typha latifolia), rzęsie drobnej (Lemna minor), sicie rozpierzchłym (Juncus effusus), osoce aloesowatej (Stratiotes aloides) i grążelu żółtym (Nuphar lutea)[21][22]. Toleruje pH w zakresie 6,0-8,0. Wykazuje dużą odporność na wysychanie – jego przedstawiciele mogą przetrwać 4-5 miesięcy bez wody (cofają ciało w głąb muszli, zamykając muszlę kilkoma przegrodami śluzowymi o różnym stopniu twardości; zagrzebują się w osady denne lub pod warstwę roślin zalegających odsłonięte dno; posiadają hemoglobinę, której ilość zwiększa się u osobników narażonych na wynurzenie, a która magazynuje znaczne ilości tlenu i stabilizuje pH krwi)[23]. Optimum termiczne to 20,5 °C[24]. Jest przy tym jednak odporny na przemarzanie – zatoczki wtopione w lód po odtajaniu często w dalszym ciągu zachowują żywotność[7].
Oddychanie
Głównym narządem oddechowym jest płuco, tworzone przez silnie unaczynioną jamę płaszcza. Brzeg płaszcza jest przekształcony w syfon oddechowy, który ślimak może wystawiać nad powierzchnię wody. Dodatkowo posiada nibyskrzele, położone z lewej strony ciała, na zewnątrz od otworu płucnego[7]. Barwnikiem oddechowym jest rozpuszczona we krwi hemoglobina, nadająca ciału charakterystyczny kolor[7].
Odżywianie
Zdrapywacz. Odżywia się detrytusem, peryfitonem, zeskrobuje radulą obumarłe, zmacerowane fragmenty roślin wodnych, a także glony i żywe tkanki roślin wodnych[7]. Najczęściej żeruje na rdestniacach (Potamogeton sp.), przęstce pospolitej (Hippuris vulgaris), okrężnicy bagiennej (Hottonia palustris), osoce aloesowatej. Preferuje żerowanie na martwych lub obumierających częściach roślin. Ślimaki żerujące na żabiścieku pływającym (Hydrocharis morsus-ranae) i rdeście ziemnowodnym (Persicaria amphibia) najpierw uszkadzają tkanki okrywające, a gdy wskutek tego liście więdną, zjadane są pozostałe tkanki. Młode zatoczki odżywiają się peryfitonem porastającym rośliny i przedmioty zanurzone[7]. Dzienne tempo konsumpcji ślimaka zmierzone w warunkach laboratoryjnych wynosiło 0,62–1,51% suchej masy ciała ślimaka. Wydajność asymilacji zaś, zależnie od typu pokarmu, wynosiła średnio od 23,1% do 63,6% skonsumowanej materii organicznej. Produkcja fekaliów wynosi średnio 35,2 mg suchej masy/1 g masy ciała/dobę[25].
Rozmnażanie
Obojnaki. Zapłodnienie krzyżowe, samozapłodnienie również możliwe[7]. W przypadku samozapłodnienia mniej niż 5% jaj rozwija się w osobniki dorosłe[8]. Rozród w warunkach Polski od kwietnia do lipca/sierpnia, niekiedy kokony jajowe można znaleźć także później – we wrześniu i październiku. Kokony jajowe są płaskie, czerwonawe, o spiralnej budowie, w środkowej części lekko zagłębione. Końcowa część kokonu jest wyciągnięta w ogon. Jaja ułożone w dwóch rzędach, nie zachodzą na siebie. Kokony są formowane przy pomocy płatów gębowych, i przyczepiane po spodniej stronie dużych liści (np. grążeli, grzybieni Nymphaea, rdestnic Potamogeton). Składanie kokonów trwa kilka minut. Kokony są początkowo białawe i miękkie, po kilkudziesięciu minutach twardnieją i stają się różowawe. Wymiary kokonów i liczba jaj w złożu zmienna: największe zawierają do 100 jaj i mają do 30 mm długości oraz 16 mm szerokości (średnio: 30–50 jaj)[7]. Jaja mają średnicę od 1,2 do 1,7 mm[8]. Embriony mają barwę czerwonawą i przezroczyste muszle. Rozwój embrionalny trwa 17–18 dni przy temperaturze 20 °C, młode potrzebują jednego-dwóch dni, by opuścić kokon. W warunkach naturalnych osobniki zatoczka rogowego mogą żyć do 2–4 lat, w warunkach hodowlanych do 5-6 lat[8][7][26].
Interakcje międzygatunkowe
- Osobniki tego gatunku są żywicielami pośrednimi wielu gatunków pasożytniczych przywr (Trematoda)[20]: Notocotylus ephemera (Nitzsch, 1807), Echinostoma spiniferum (La Valette, 1855), Haematoloechus asper (Looss, 1899), Rubenstrema opisthovitellinum Soltys, 1954, Rubenstrema exasperatum (Rudolphi, 1819), Tylodelphys excavata (Rudolphi, 1803), Bilharziella polonica (Kowalewski, 1895), Echinoparyphium aconiatum, Moliniella anceps[7][27][28]. W niektórych populacjach tego ślimaka stwierdzono występowanie cerkarii i metacerkarii 11 gatunków przywr, aż do 78% osobników było nimi zarażonych[29][27].
- Na zatoczkach rogowych żerują drapieżne pijawki (m.in. przylepka spłaszczona (Glossiphonia complanata) i pijawka końska (Haemopis sanguisuga)) i drapieżne larwy chruścików, raki, ryby, gady, ptaki i ssaki żyjące nad wodą[7][30]. Ze względu na duże wymiary ciała i stosunkowo mocną muszlę jest mniej chętnie niż inne gatunki planispiralnych ślimaków konsumowany przez niektóre drapieżne bezkręgowce[31].
- W muszli żywych zatoczków rogowych może zamieszkiwać komensaliczny skąposzczet Chaetogaster limnei[7]. W nerce i moczowodzie tych ślimaków może natomiast występować podgatunek tego skąposzczeta: Chaetogaster limnei vaghini Gruffydd[29].
Zagrożenie i ochrona
Ze względu na szerokie rozprzestrzenienie, dużą liczebność populacji, odporność na eutrofizację oraz wahania warunków siedliskowych IUCN przypisała zatoczkowi rogowemu status gatunku najmniejszej troski (LC)[1].
Znaczenie
Zatoczek rogowy w niektórych siedliskach i niektórych typach zbiorników wodnych jest jednym z dominujących gatunków mięczaków i jako taki odgrywa dużą rolę w produkcji i transformacji detrytusu, a w rezultacie w obiegu materii w ekosystemie[12][25][22].
Zatoczek rogowy jest wykorzystywany jako gatunek modelowy w badaniach nad ewolucją odpowiedzi immunologicznej oraz mechanizmów sygnalizacji neuroendokrynnej[32][33][34]. W hemolimfie zatoczka rogowego wykryto komórki o charakterystyce zbliżonej do charakterystyki ssaczych komórek NK, wykazujące aktywność cytotoksyczną. Jest to dowód wspierający hipotezę, według której komórki NK pojawiły się wcześnie w ewolucji, niezależnie od komórek żernych, i nie są właściwe wyłącznie kręgowcom[35].
Larwy i postacie dorosłe przywr, których żywicielem pośrednim jest między innymi zatoczek rogowy, pasożytują na wielu gatunkach kręgowców, powodując choroby zwane trematodozami[29][36][37][38]. Larwy niektórych spośród tych gatunków mogą być również patogenne dla człowieka w sposób pośredni, powodując u osób kąpiących się w zbiornikach wodnych, do wód których zostały uwolnione np. z ciała ślimaka, zapalenie skóry, wysypkę i swędzenie (dermatitis)[39][40].
Zatoczek rogowy jest gatunkiem popularnym wśród akwarystów: w hodowlach amatorskich formy typowe są wykorzystywane jako pokarm dla ryb oraz „czyściciele” zjadający glony porastające ścianki akwariów, ze względów estetycznych szczególnie poszukiwane są formy albinotyczne i hodowlane formy barwne[41]. W związku z tym gatunek ten jest przedmiotem handlu, można się spodziewać zawleczenia poza obszar naturalnego występowania[1].
Zobacz też
Przypisy
- ↑ a b c d e f Planorbarius corneus, [w:] The IUCN Red List of Threatened Species [online] (ang.).
- ↑ Linnaeus C. 1758. Systema Naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Tomus I. Editio decima, reformata - Vermes. Testacea: 700–781. Holmiae. (Salvius). Str. 770.
- ↑ a b c d Garbar D.A. & A.V. Garbar. 2007. Karyological features of the genus Planorbarius (Gastropoda, Pulmonata, Bulinidae) of the Ukranian fauna. Cytology and Genetics 41(2): 109-114.
- ↑ Mezhezherin S.V., Garbar D.A., Garbar A.V. 2005. Systematic structure of the complex Planorbarius corneus (Linnaeus, 1758) s.l.: Analysis of allozyme markers and morphometric characters. Vestn. Zool. 39(6): 11.
- ↑ Kazimierz Kumaniecki: Słownik łacińsko-polski. Warszawa: PWN, 1975, s. 546.
- ↑ a b Kantor Yu. I., Vinarski M. V., Schileyko A. A. & Sysoev A. V. 2010. Catalogue of the continental mollusks of Russia and adjacent territories. Ruthenica pdf, (opublikowany online: 2 marca 2010)
- ↑ a b c d e f g h i j k l m n o Piechocki 1979 ↓.
- ↑ a b c d e f Species summary for Planorbarius corneus. AnimalBase, 2011. [dostęp 2014-04-27]. (ang.).
- ↑ Urbański 1957 ↓.
- ↑ Kołodziejczyk i Koperski 2000 ↓.
- ↑ Fauna Polski - charakterystyka i wykaz gatunków. Bogdanowicz W., Chudzicka E., Pilipiuk I. i Skibińska E. (red.). T. III. Warszawa: Muzeum i Instytut Zoologii PAN, 2008, s. 420. ISBN 978-83-88147-09-8.
- ↑ a b Spyra A., Serafiński W., Strzelec M. 2007. The species diversity of freshwater snails in differently managed fish ponds in sout-western Poland. Ekologia (Bratislava) 26(1): 83-89.
- ↑ a b Piechocki 1979 ↓, s. 23.
- ↑ a b c Zhukov V.V., M.B. Bobkova, I.A. Vakolyuk. 2002. Eye structure and vision in the freshwater pulmonate mollusc Planorbarius corneus. J. Evol. Biochemistry and Physiol. 38(4): 419-430. doi: 10.1023/A:1021101919847
- ↑ Gál J., M.V. Bobkova, V.V. Zhukov, I.P. Shepeleva & V. B. Meyer-Rochow. 2004. Fixed focal-length optics in pulmonate snails (Mollusca, Gastropoda): squaring phylogenetic background and ecophysiological needs. Invertebrate Biology 123(2): 116–127 DOI: 10.1111/j.1744-7410.2004.tb00147.x
- ↑ Lombardo F., R. Maramaldo, B. Fratello, D. Sonetti. 1992. Amino acids and derivatives as food-finding signals in the freshwater snail Planorbarius corneus (L.). Comparative Biochemistry and Physiology Part C: Comparative Pharmacology 101(2): 389–398. DOI: 10.1016/0742-8413(92)90292-F
- ↑ Jackiewicz, M. 2007. Tentacle regeneration in Planorbarius corneus (Linnaeus, 1758) and Cepaea hortensis (OF Muller, 1774) (Gastropoda: Pulmonata). Folia Malacologica 8(3): 233-237.
- ↑ Piechocki 1979 ↓, s. 24.
- ↑ Bottke W. 1984. Heterochromatin in a pulmonate snail Planorbarius corneus. Caryologia 35(4): 443.
- ↑ a b Bezkręgowce. Warszawa: Wiedza Powszechna, 1984, seria: Mały słownik zoologiczny. ISBN 83-214-0428-6.
- ↑ Zealand A.M. & M.J. Jeffries. 2009. The distribution of pond snail communities across a landscape: separating out the influence of spatial position from local habitat quality for ponds in south-east Northumberland, UK. Hydrobiologia 632(1): 177-187.
- ↑ a b Kołodziejczyk, A. 1984. Occurence of Gastropoda in the lake littoral and their role in the production and trasformation of detritus. Snails in the littoral of Mikolajskie lake – general characteristics of occurence. Ekologia Polska 32(3): 441-468.
- ↑ Aliakrinskaja I.O. 1971. Niekotoryje adaptacji Mytilus galloprovincialis (Bivalvia) i Planorbis corneus (Gastropoda) k otsustwiju wody. Zool. Żurn. 50: 648-656
- ↑ Costil, K. 1993. 1994. Influence of temperature on survival and growth of two freshwater planorbid species, Planorbarius corneus (L.) and Planorbis planorbis (L.). J. Mollus. Stud. 60(3): 223-235. doi: 10.1093/mollus/60.3.223
- ↑ a b Kołodziejczyk, A. 1984. Occurence of Gastropoda in the lake littoral and their role in the production and trasformation of detritus. Ecological activity of snails. Ekologia Polska 32(3): 469-492.
- ↑ Berrie, A.D. 1963. Life cycle of Planorbarius corneus (L.). Nature 198: 805–806, doi:10.1038/198805a0
- ↑ a b Anna Faltýnková. Larval trematodes (Digenea) in molluscs from small water bodies near Šeské Budšjovice, Czech Republic.. „Acta Parasitologica”. 50 (1), s. 49–55, 2005. ISSN 1230-2821.
- ↑ R. Brown, M. Soldánová, J. Barrett, A. Kostadinova. Small-scale to large-scale and back: larval trematodes in Lymnaea stagnalis and Planorbarius corneus in Central Europe.. „Parasitol. Res.”. 108 (1), s. 137-50, 2011. DOI: 10.1007/s00436-010-2047-z. PMID: 20878185.
- ↑ a b c Piechocki 1979 ↓, s. 40.
- ↑ Consul, A. Eger, S. & Kwet, A. 2009. The grass snake, Natrix natrix natrix (Squamata: Colubridae) as a predator of the great ramshorn snail, Planorbarius corneus (Gastropoda: Planorbidae). Salamandra 45: 50-52. ISSN 0036-3375
- ↑ Renai B. & F. Gherardi. 2004. Predatory efficiency of crayfish: comparison between indigenous and non-indigenous species. Biol. Inv. 6: 89-99.
- ↑ Ottaviani E, Franchini A, Kletsas D. 2001. PDGF and TGF-β in invertebrate immune and neuroendocrine interactions: another sign of conservation in evolution. Comp. Biochem. Physiol. 129C: 295-306.
- ↑ Bolshakov V.Yu, S. A. Gapon & L. G. Magazanik. 1992. Transduction mechanism for glutamate-induced potassium current in neurones of the mollusc Planorbarius corneus. Journal of Physiology, 455: 33-50.
- ↑ Ottaviani E., E. Caselgrandi, C. Franceschi. 1995. Biochemical and Biophysical Research Communications 207(1): 288–292. DOI: 10.1006/bbrc.1995.1185
- ↑ Franceschi C., A. Cossarizza, D. Monti & E. Ottaviani. 1991. Cytotoxicity and immunocyte markers in cells from the freshwater snail Planorbarius corneus (L.) (Gastropoda Pulmonata): implications for the evolution of natural killer cells. European Journal of Immunology 21(2): 489–493. doi: 10.1002/eji.1830210235
- ↑ Rajski, A. 1994. Zoologia, t.2. str. 74. PWN, Warszawa. ISBN 83-01-07946-0
- ↑ Hung N.M., H. Madsen, B. Fried. 2013. Global status of fish-borne zoonotic trematodiasis in humans. Acta Parasitologica 58(3): 231-258.
- ↑ Muller M.G.. 2010. Common avian parasites and emerging diseases. W: Veterinary parasitology, str: 87-111. Ed. G.V. LaMan. Nova Biomedical Press, New York. ISBN 978-1-61122-550-1
- ↑ De Gentile L, Picot H, Bourdeau P, Bardet R, Kerjan A, Piriou M, Le Guennic A, Bayssde-Dufour C, Chabasse D, Mott KE. 1996. Cercarial dermatitis in Europe: a new public health problem? Bull. World Health Org. 74: 159–163
- ↑ Żbikowska, E. 2004. Infection of snails with bird schistosomes and the threat of swimmers itch in selected Polish lakes. Parasitol. Res. 92: 30–35.
- ↑ Red Ramshorn.co.uk - Breeding Ramshorn Snails. [dostęp 2014-08-25]. [zarchiwizowane z tego adresu (2014-10-05)].
Bibliografia
- Andrzej Kołodziejczyk, Paweł Koperski: Bezkręgowce słodkowodne Polski: klucz do oznaczania oraz podstawy biologii i ekologii makrofauny. Warszawa: Wydawnictwa Uniwersytetu Warszawskiego, 2000, s. 249. ISBN 83-235-0192-0.
- Andrzej Piechocki: Mięczaki (Mollusca): ślimaki (Gastropoda). T. 7: Fauna słodkowodna Polski. Warszawa, Poznań: Państwowe Wydawnictwo Naukowe, 1979, s. 187. ISBN 83-01-01143-2.
- Jerzy Urbański: Krajowe ślimaki i małże. Warszawa: PZWS, 1957, s. 276.
Linki zewnętrzne
- Planorbarius corneus w NCBI NCBI, dostęp: 27 kwietnia 2014.
- Pesticides Database - Chemical Toxicity Studies, wpływ pestycydów na zatoczka rogowego
Media użyte na tej stronie
Autor: Donkey shot, Licencja: CC BY-SA 3.0
Great Ramshorn (Planorbarius corneus) in a ditch near Riddagshausen (Braunschweig/Germany)
Autor: H. Zell, Licencja: CC BY-SA 3.0
Nuphar lutea, Nymphaeaceae, Yellow Water-lily, habitus.
Autor: Claus Ableiter, Licencja: CC-BY-SA-3.0
Photo of an albino great ramshorn (Planorbarius corneus) eating algae from the concrete in a lily pond.
Zatoczek rogowy
Autor: Silvana Gericke (http://abilo.piranho.de/aquaseite/aqua.htm), Licencja: CC BY 3.0
Planorbarius corneus








