Zespół LEOPARD
| |||
 | |||
| |||
| DiseasesDB | 7387 | ||
Zespół LEOPARD (ang. LEOPARD syndrome) – rzadki, uwarunkowany genetycznie, dziedziczony autosomalnie dominująco zespół wad wrodzonych, spowodowany w większości przypadków mutacją w niereceptorowym genie PTPN11 kodującym białko fosfatazy tyrozynowej[1]. Mutacje w tym samym genie odpowiadają za część przypadków zespołu Noonan; są to zatem schorzenia alleliczne. Nazwa zespołu jest akronimem utworzonym z pierwszych nazw głównych objawów choroby w języku angielskim: plam soczewicowatych na skórze (Lentiginosis), nieprawidłowego obrazu EKG (ECG), hiperteloryzmu ocznego (Ocular hypertelorism), zwężenia ujścia płucnego (Pulmonary stenosis), nieprawidłowości narządów płciowych zewnętrznych (Abnormal genitalia), zahamowania wzrostu (Retardation of growth) i czuciowo-nerwowej utraty słuchu (Deafness). U jednego pacjenta może występować kilka z tych objawów.
Historia i nazewnictwo
Jako pierwsi opisali ten zespół Zeisler i Becker w 1936 roku, u 24-letniej kobiety z mnogimi plamami soczewicowatymi, kurzą klatką piersiową, hiperteloryzmem i prognatyzmem[2]. Inne wczesne opisy choroby były autorstwa E.J. Moynahana[3] oraz Arnolda J. Capute'a i wsp.[4]. Robert J. Gorlin, Roy C. Anderson i Michael Blaw w 1969 roku w przeglądzie piśmiennictwa wskazali na inne cechy zespołu i zaproponowali nazwę multiple lentigines syndrome oraz mnemotechniczny skrót LEOPARD[5]. Inne, spotykane w piśmiennictwie nazwy to:
- cardiomyopathic lentiginosis
- progressive cardiomyopathic lentiginosis
- lentiginosis profusa
- zespół sercowo-skórny (cardio-cutaneous syndrome)
- zespół Gorlina II (Gorlin's syndrome II)
- zespół Capute'a-Rimoina-Konigsmarka-Esterly-Richardsona (Capute-Rimoin-Konigsmark-Esterly-Richardson syndrome)
- zespół Moynahana (Moynahan syndrome).
Epidemiologia
W literaturze przedstawiono dotąd około 200 przypadków zespołu[6]. Przypuszczalnie faktyczna częstość choroby jest znacznie wyższa, a zespół jest niedodiagnozowany[6].
Zespół jest nieco częstszy u płci męskiej niż żeńskiej[7]. Uważa się, podobnie jak w przypadku zespołu Noonan, że jest to wynik większej przeżywalności męskich homozygot względem zmutowanego w zespole LEOPARD genu[8].
Etiologia
Zespół LEOPARD może występować sporadycznie lub rodzinnie, odziedziczony w sposób autosomalny dominujący. U około 85% pacjentów z pewnym rozpoznaniem zespołu stwierdza się mutacje missens w genie PTPN11 w locus 12q24.1[9][10]. U około 3% pacjentów stwierdza się mutacje w innym genie, RAF1 w locus 3p25 [OMIM*164170]. Mutacje mają charakter missens i dotyczą eksonów 7, 14 i 17 tego genu[11]. Gen PTPN11 koduje białko fosfatazy białkowej SHP2 zawierającej domenę SH2 (SRC homology 2), charakteryzujące się dwiema ułożonymi tandemowo domenami SH2 (N-SH2 i C-SH2) i jedną domeną fosfatazy tyrozynowej. Białko SHP2 działa w komórce jako cytoplazmatyczny przekaźnik sygnału pośredniczący w działaniach wielu receptorów dla hormonów, cytokin i czynników wzrostu, szczególnie w szlakach zależnych od kinaz aktywowanych przez RAS (kinazy MAPK)[12][13]. Według danych z 2008 roku[6] znanych jest 11 różnych mutacji missens w genie PTNP11 związanych z zespołem LEOPARD, w eksonach 7, 12 i 13 (Tyr279Cys/Ser, Ala461Thr, Gly464Ala, Thr468Met/Pro, Arg498Trp/Leu, Gln506Pro i Gln510Glu/Gly), z czego dwie (Tyr279Cys i Thr468Met) występują w około 65% przypadków[6]. Germinalne mutacje w genie PTPN11 występują też w 40–50% przypadków zespołu Noonan i zespołu Noonan-like/Multiple Giant Cell lesions[14][15]. Jak dotąd, znane mutacje wydają się być charakterystyczne dla każdego z tych dwóch zespołów, przedstawiając wyraźną korelację genotyp-fenotyp[6].
Zespół LEOPARD należy do tzw. zespołów nerwowo-sercowo-twarzowo-skórnych (neuro-cardio-facial-cutaneous syndromes), tak jak najczęstszy w tej grupie chorób zespół Noonan[16]. Zespoły NCFC (oprócz dwóch wspomnianych, jeszcze nerwiakowłókniakowatość typu 1, zespół Costello i zespół sercowo-twarzowo-skórny) są spowodowane mutacjami genów kodujących białka szlaku sygnalizacyjnego Ras. Fenotypy tych zespołów są zbliżone, z objawami skórnymi, wadami serca, kośćca i narządów płciowych, cechami dysmorficznymi twarzy i różnego stopnia opóźnieniem umysłowym. (patrz: Rozpoznanie różnicowe).
Objawy i przebieg

Na fenotyp zespołu LEOPARD składają się[6][17][18]:
- niskorosłość (mniej niż 50%[19])
- opóźnienie wzrostu w okresie postnatalnym (noworodki mają prawidłową masę urodzeniową, niekiedy powyżej 97. percentyla)[19]
- cechy dysmorficzne twarzy określa się jako podobne do zespołu Noonan, ale łagodniej nasilone[19][20]. Są to:
- prognatyzm
- trójkątna twarz
- antymongoloidalne ustawienie szpar powiekowych
- guzy skroniowe
- wydatne małżowiny uszne
- nisko osadzone małżowiny uszne
- uszy zrotowane do tyłu
- hiperteloryzm oczny, praktycznie w 100% przypadków[6]
- ptoza (rzadziej)
- grube wargi (rzadziej)
- zmarszczki nakątne
- wyraźnie zaznaczone fałdy nosowo-wargowe
- przedwczesne zmarszczki skóry u dorosłych pacjentów
- szeroki, płaski nos
- czuciowo-nerwowa utrata słuchu (15-25%[1][9][19]), rozpoznawana zwykle po urodzeniu lub w dzieciństwie, rzadziej rozwija się w ciągu życia[6]
- płetwistość szyi lub nadmiar skóry karku (37%)[21]
- krótka szyja
- zez
- rozszczep podniebienia
- hiposmia
- wady serca (około 85%)[19][22]
- zastawkowa stenoza płucna (40%)[18]
- kardiomiopatia przerostowa (20%), o początku zwykle poprzedzającym pojawienie się plam soczewicowatych
- zwężenie podzastawkowe aorty
- ubytki przegrody międzyprzedsionkowej lub międzykomorowej (rzadziej)
- wypadanie płatka zastawki mitralnej (rzadziej)
- wady naczyń wieńcowych (rzadziej)
- zwężenie drogi odpływu prawej lub lewej komory
- śluzak przedsionka (rzadko)
- nieprawidłowości elektrokardiograficzne (około 75%)[6]:
- lewogram patologiczny (-60 do -120°)
- całkowity blok serca
- bloki odnóg pęczka Hisa
- wady układu kostnego
- odstające łopatki
- klatka piersiowa szewska
- klatka piersiowa kurza
- hiperteloryzm brodawek sutkowych (teletelia)
- nieprawidłowa liczba żeber
- kifoskolioza
- utajony rozszczep kręgosłupa
- łokcie koślawe
- ograniczenie ruchomości w stawie łokciowym
- nadmierna ruchomość w stawach
- wady układu moczowo-płciowego:
- spodziectwo (50%)
- mikropenis
- wnętrostwo jedno- lub obustronne (50%)[6]
- hipoplastyczne lub aplastyczne jajniki
- jednostronna agenezja nerki, nerka podkowiasta (rzadko)[7][17][20]
- zmiany skórne i w obrębie przydatków skóry:
- ciemne plamy soczewicowate średnicy 1–5 mm (do 5 cm)[18], przede wszystkim na karku i tułowiu, pojawiające się w niemowlęctwie i wczesnym dzieciństwie, zwiększające swoją liczbę z wiekiem
- plamy soczewicowate mogą nie występować
- plamy cafe au lait (38%[18])
- miejscowa hipopigmentacja skóry (rzadko)[23]
- nadmiar skóry między palcami[18]
- steatocystoma multiplex (pojedyncze przypadki)[24]
- nadmierna wiotkość skóry[18][24][25]
- nieprawidłowości dermatoglifów[18]
- trudności poznawcze lub łagodne opóźnienie umysłowe (około 30%[19])
- późna menarche
- opóźnione pokwitanie
- predyspozycja do nowotworów i schorzeń hematologicznych:
- mielodysplazja (pojedyncze przypadki)[6]
- ostra białaczka mielomonocytowa (pojedyncze przypadki)[26]
- neuroblastoma (pojedyncze przypadki)[27]
- czerniak złośliwy (pojedyncze przypadki)[28]
- obustronne choristomata rogówki (pojedyncze przypadki)[29].
Rozpoznanie
Zaproponowano kryteria rozpoznania zespołu LEOPARD (Voron et al., 1976[7])
- Plamy soczewicowate + dwie inne cechy zespołu
- Członek rodziny z rozpoznaniem LS + przynajmniej trzy cechy zespołu (w przypadku braku plam soczewicowatych).
Rozpoznanie różnicowe
- zespół Turnera
- zespół Watsona
- zespół sercowo-twarzowo-skórny (CFCS)
- zespół Costello
- zespół NAME
- zespół Peutza-Jeghersa
- zespół NFNS (zespół neurofibromatoza-Noonan)
- zespół Williamsa.
Leczenie
Zalecane postępowanie w zespole LEOPARD, prowadzenie i leczenie pacjentów w wielu punktach jest takie samo jak w zespole Noonan[30]. Wyjściowe badanie po postawieniu rozpoznania powinno obejmować kompletne badanie fizykalne, specjalistyczną ocenę kardiologiczną, urologiczną, neurologiczną oraz audiologiczną. Zaleca się badanie molekularne w kierunku mutacji PTPN11 i RAF1.
Dalsze postępowanie zależy od fenotypu pacjenta:
- w przypadku nieprawidłowości układu krążenia, zaleca się okresowe kardiologiczne badanie kontrolne. W innych przypadkach wystarcza badanie raz do roku
- przypadki ciężkiej dysplazji aparatu zastawkowego mogą być wskazaniem do walwulotomii albo walwulektomii[22]
- pacjenci z kardiomiopatią przerostową powinni być prowadzeni według odpowiednich algorytmów opracowanych dla pacjentów z HCM[6][31]
- u chorych z dużym gradientem ciśnień między lewą komorą a aortą zaleca się farmakoterapię beta-blokerami lub blokerami kanału wapniowego
- w przypadku niepowodzenia leczenia farmakologicznego należy rozważyć leczenie operacyjne
- przypadki nagłych zgonów sercowych u pacjentów z HCM skłaniają ku wnikliwej ocenie ryzyka oraz wdrożenia odpowiedniej profilaktyki
- leczenie bloków przewodzenia tak jak w populacji ogólnej, ocena EKG raz na rok
- ocena audiologiczna raz na rok przed osiągnięciem dorosłości, aparat słuchowy lub implant ślimakowy w razie potrzeby[6]
- do rozważenia terapia hormonem wzrostu w przypadku niedoboru wzrostu w dzieciństwie
- w przypadku mnogich plam soczewicowatych, zaleca się ochronę anty-UV-A i UV-B
- większość dorosłych pacjentów z zespołem LEOPARD nie wymaga specjalistycznej opieki lekarskiej, a rokowanie jest dobre.
Przypisy
- ↑ a b Coppin BD, Temple IK. Multiple lentigines syndrome (LEOPARD syndrome or progressive cardiomyopathic lentiginosis). „J Med Genet”. 34. 7, s. 582-6, 1997. PMID: 9222968. PDF
- ↑ Zeisler EP, Becker S. Generalized Lentigo. „Arch Dermat Syph”. 33, s. 109-25, 1936.
- ↑ Moynahan EJ. Multiple symmetrical moles, with psychic and somatic infantilism and genital hypoplasia: first male case of a new syndrome. „Proc Roy Soc Med”. 55, s. 959-960, 1962.
- ↑ Capute AJ, Rimoin DL, Konigsmark BW, Esterly NB, Richardson F. Congenital deafness and multiple lentigines. A report of cases in a mother and daughter. „Arch Dermatol”. 100. 2, s. 207-13, 1969. PMID: 5797963.
- ↑ Gorlin RJ, Anderson RC, Blaw M. Multiple lentigenes syndrome. „Am J Dis Child”. 117. 6, s. 652-62, 1969. PMID: 5771505.
- ↑ a b c d e f g h i j k l m Sarkozy A, Digilio MC, Dallapiccola B. LEOPARD syndrome. „Orphanet J Rare Dis”. 3. 1, s. 13, 2008. DOI: 10.1186/1750-1172-3-13. PMID: 18505544.
- ↑ a b c Voron DA, Hartfield HH, Kalkhoff MD: Multiple lentigines syndrome. Case report and review of the literature. Am J Med 60:447–456, 1976.
- ↑ Marco Tartaglia i inni, Paternal germline origin and sex-ratio distortion in transmission of PTPN11 mutations in Noonan syndrome, „American Journal of Human Genetics”, 75 (3), 2004, s. 492–497, DOI: 10.1086/423493, PMID: 15248152, PMCID: PMC1182027.
- ↑ a b Sarkozy A, Conti E, Digilio MC, Marino B, Morini E, Pacileo G, Wilson M, Calabrò R, Pizzuti A, Dallapiccola B. Clinical and molecular analysis of 30 patients with multiple lentigines LEOPARD syndrome. „J Med Genet”. 41. 5, s. e68, 2004. PMID: 15121796.PDF
- ↑ Digilio MC, Conti E, Sarkozy A, Mingarelli R, Dottorini T, Marino B, Pizzuti A, Dallapiccola B. Grouping of multiple-lentigines/LEOPARD and Noonan syndromes on the PTPN11 gene. „Am J Hum Genet”. 71. 2, s. 389-94, 2002. DOI: 10.1086/341528. PMID: 12058348.
- ↑ Pandit B, Sarkozy A, Pennacchio LA, Carta C, Oishi K, Martinelli S, Pogna EA, Schackwitz W, Ustaszewska A, Landstrom A, Bos JM, Ommen SR, Esposito G., Lepri , Faul C, Mundel P, López Siguero JP, Tenconi R, Selicorni A, Rossi C, Mazzanti L, Torrente I, Marino B, Digilio MC, Zampino G, Ackerman MJ, Dallapiccola B, Tartaglia M, Gelb BD. Gain-of-function RAF1 mutations cause Noonan and LEOPARD syndromes with hypertrophic cardiomyopathy. „Nat Genet”. 39. 8, s. 1007-12, 2007. DOI: 10.1038/ng2073. PMID: 17603483.
- ↑ Neel BG, Gu H, Pao L. The 'Shp'ing news: SH2 domain-containing tyrosine phosphatases in cell signaling. „Trends Biochem Sci”. 28. 6, s. 284-93, 2003. PMID: 12826400.
- ↑ Tartaglia M, Niemeyer CM, Shannon KM, Loh ML. SHP-2 and myeloid malignancies. „Curr Opin Hematol”. 11. 1, s. 44-50, 2003. PMID: 14676626.
- ↑ Tartaglia M, Mehler EL, Goldberg R, Zampino G, Brunner HG, Kremer H, van der Burgt I, Crosby AH, Ion A, Jeffery S, Kalidas K, Patton MA, Kucherlapati RS, Gelb BD. Mutations in PTPN11, encoding the protein tyrosine phosphatase SHP-2, cause Noonan syndrome. „Nat Genet”. 29. 4, s. 465-8, 2001. DOI: 10.1038/ng772. PMID: 11704759. Korekta w „Nature Genetics”, 29 (4), 2001, s. 491, DOI: 10.1038/ng1201-491c, ISSN 1061-4036, PDF.
- ↑ Tartaglia M, Gelb BD. Noonan syndrome and related disorders: genetics and pathogenesis. „Annu Rev Genomics Hum Genet”. 6, s. 45-68, 2005. DOI: 10.1146/annurev.genom.6.080604.162305. PMID: 16124853.
- ↑ Mohamed Bentires-Alj, Maria I. Kontaridis, Benjamin G. Neel, Stops along the RAS pathway in human genetic disease, „Nature Medicine”, 12 (3), 2006, s. 283-285, DOI: 10.1038/nm0306-283, PMID: 16520774.
- ↑ a b LEOPARD SYNDROME 1 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ a b c d e f g LEOPARD Syndrome. W: Harold Chen: Atlas of Genetic Diagnosis and Counselling. Totowa, NJ: Humana Press, 2006, s. 597-599. ISBN 1-59259-956-7.
- ↑ a b c d e f Bruce D. Gelb, Marco Tartaglia. LEOPARD Syndrome GeneReviews
- ↑ a b Digilio MC, Sarkozy A, de Zorzi A, Pacileo G, Limongelli G, Mingarelli R, Calabrò R, Marino B, Dallapiccola B. LEOPARD syndrome: clinical diagnosis in the first year of life. „Am J Med Genet A”. 140. 7, s. 740-6, 2006. DOI: 10.1002/ajmg.a.31156. PMID: 16523510.
- ↑ Somerville J, Bonham-Carter RE. The heart in lentiginosis. „Br Heart J”. 34. 1, s. 58-66, 1972. PMID: 4258224. PDF
- ↑ a b Limongelli G, Pacileo G, Marino B, Digilio MC, Sarkozy A, Elliott P, Versacci P, Calabro P, De Zorzi A, Di Salvo G, Syrris P, Patton M, McKenna WJ, Dallapiccola B, Calabro R. Prevalence and clinical significance of cardiovascular abnormalities in patients with the LEOPARD syndrome. „Am J Cardiol”. 100. 4, s. 736-41, 2007. DOI: 10.1016/j.amjcard.2007.03.093. PMID: 17697839.
- ↑ Selmanowitz VJ, Orentreich N, Felsenstein JM. Lentiginosis profusa syndrome (multiple lentigines syndrome). „Arch Dermatol”. 104. 4, s. 393-401, 1972. PMID: 5000391.
- ↑ a b Mochizuki-Osawa M, Terui T, Kato T, Tagami H. LEOPARD syndrome associated with steatocystoma multiplex and hyperelastic skin Report of a Japanese case. „Acta Derm Venereol”. 75. 4, s. 323-4, 1996. PMID: 8578962.
- ↑ Ohkura T, Ohnishi Y, Kawada A, Tajima S, Ishibashi A, Ono K. Leopard syndrome associated with hyperelastic skin: analysis of collagen metabolism in cultured skin fibroblasts. „Dermatology”. 198. 4, s. 385-7, 1999. PMID: 10449938.
- ↑ Uçar C, Calýskan U, Martini S, Heinritz W. Acute myelomonocytic leukemia in a boy with LEOPARD syndrome (PTPN11 gene mutation positive). „J Pediatr Hematol Oncol”. 28. 3, s. 123-5, 2006. DOI: 10.1097/01.mph.0000199590.21797.0b. PMID: 16679933.
- ↑ Merks JH, Caron HN, Hennekam RC. High incidence of malformation syndromes in a series of 1,073 children with cancer. „Am J Med Genet A”. 134A. 2, s. 132-43, 2005. DOI: 10.1002/ajmg.a.30603. PMID: 15712196.
- ↑ Seishima M, Mizutani Y, Shibuya Y, Arakawa C, Yoshida R, Ogata T. Malignant melanoma in a woman with LEOPARD syndrome: identification of a germline PTPN11 mutation and a somatic BRAF mutation. „Br J Dermatol”. 157. 6, s. 1297-9, 2007. DOI: 10.1111/j.1365-2133.2007.08229.x. PMID: 17927788.
- ↑ Choi WW, Yoo JY, Park KC, Kim KH. LEOPARD syndrome with a new association of congenital corneal tumor, choristoma. „Pediatr Dermatol”. 20. 2, s. 158-60, 2003. PMID: 12657016.
- ↑ Ineke van der Burgt, Noonan syndrome, „Orphanet Journal of Rare Diseases”, 14 (2), 2007, s. 4, DOI: 10.1186/1750-1172-2-4, PMID: 17222357, PMCID: PMC1781428.
- ↑ Perry Elliott, William J. McKenna, Hypertrophic cardiomyopathy, „The Lancet”, 363 (9424), 2004, s. 1881-1891, DOI: 10.1016/S0140-6736(04)16358-7, PMID: 15183628.
Linki zewnętrzne
- Bruce D. Gelb, Marco Tartaglia. LEOPARD Syndrome
- LEOPARD SYNDROME 1 w bazie Online Mendelian Inheritance in Man (ang.)
- Sergiusz Jóźwiak, Robert A. Schwartz. LEOPARD Syndrome eMedicine (ang.)
- Gorlin's syndrome II w bazie Who Named It (ang.)
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: see above, Licencja: CC BY 2.0
Numerous lentigines in the upper part of the trunk in a 2 year old child with a PTPN11 gene mutation.
Autor: see above, Licencja: CC BY-SA 3.0
Multiple lentigines on the lower leg (37 year-old male patient with LEOPARD syndrome).
Autor: see above, Licencja: CC BY 2.0
Five year-old girl with multiple lentigines, cafè-au-lait spots and dysmorphic features. Note the short neck with pterigium colli, teletelia, pectus excavatum and diffuse lentiginosis on the trunk.
PTPN11 gene
Autor: see above, Licencja: CC BY 2.0
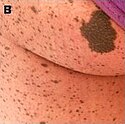
Lentigines and a large cafè-au-lait spot (28 year-old female patient with LEOPARD syndrome).
Autor: see above, Licencja: CC BY 2.0
Five year-old girl with multiple lentigines, cafè-au-lait spots and dysmorphic features. Note the hyperthelorism, ptosis, blue eyes and low set dysmorphic ears.