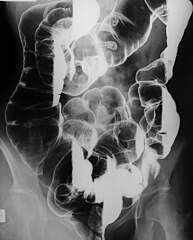
Zespół Peutza-Jeghersa
(c) robhengxr of Flickr, CC BY 2.0 Liczne polipy w jelicie grubym | |
| ICD-10 | Q85.8 |
|---|---|
| DiseasesDB | |
| OMIM | |
| MeSH | |
Zespół Peutza-Jeghersa, PJS (od ang. Peutz–Jeghers syndrome) – genetycznie uwarunkowany zespół cechujący się występowaniem plam soczewicowatych na skórze warg i palców ręki oraz na błonie śluzowej policzków, obecnością polipów hamartomatycznych w przewodzie pokarmowym i predyspozycją do nowotworów złośliwych w różnych narządach. Polipy mogą występować w każdym odcinku przewodu pokarmowego, ale najczęściej dotyczą jelita cienkiego. Ujawniają się zwykle u młodych dorosłych, u których bywają przyczyną krwawienia z przewodu pokarmowego i związanej z tym niedokrwistości, a także niedrożności i wgłobienia jelit.
Epidemiologia
Zespół Peutza-Jeghersa jest rzadką chorobą, o częstości szacowanej na 1:150 000 w Ameryce Północnej i Europie Zachodniej[1], chociaż częstość zespołu szacowano też na 1:8 300 żywych urodzeń[2]. W Wielkiej Brytanii żyje około 2000 osób z rozpoznaniem PJS, co sugeruje częstość choroby w tamtejszej populacji rzędu 1:30 000[3]. Choroba dotyka różne grupy etniczne; rozpoznania stawiane są równie często u mężczyzn jak u kobiet.
Etiologia
Jest to choroba dziedziczona autosomalnie dominująco, w większości przypadków stwierdza się mutację genu supresorowego LKB1 (znanego też jako STK11) w locus 19p13.3[4][5]. Gen LKB1 koduje kinazę serynowo-tyreoninową. Mutacje LKB1 stwierdza się u blisko 100% pacjentów z dodatnim wywiadem rodzinnym w kierunku choroby i u około 90% pacjentów bez krewnych z PJS[6]. Około 50% probandów ma rodzica z rozpoznanym PJS i u około 50% wywiad rodzinny w kierunku PJS jest ujemny, ale procent mutacji de novo w genie LKB1 jest nieznany z powodu często subtelnych objawów klinicznych nie pozwalających na rozpoznanie choroby u krewnych probanda, i niskiej dostępności badań genetycznych[6].
Dowodzono związku z PJS innych loci niż 19p13.3, między innymi sąsiedniego 19p13.4[7].
Korelacja genotyp-fenotyp
W badaniu na 132 pacjentach z PJS ze stwierdzonymi mutacjami w LKB1 stwierdzono, że mutacje w obszarze genu kodującym domenę wiążącą ATP związane są z mniejszym ryzykiem rozwoju nowotworu, podczas gdy mutacje zmieniające sekwencję aminokwasową domeny kinazowej rozpoznającej substrat są częste u pacjentów z PJS i nowotworami. Pacjentki z PJS i rakiem sutka najczęściej miały mutacje nonsensowne powodujące skrócenie łańcucha polipeptydowego kinazy STK11[8].
Patofizjologia

Kinaza LKB1 przez aktywację kinazy zależnej od AMP (AMPK) wpływa na szlak kinazy mTOR, pośrednio przez modulację aktywności kompleksu hamartyna-tuberyna (TSC1-TSC2). Inhibicja mTOR, przez takie związki jak rapamycyna i CCI-779, jest szlakiem o potencjale terapeutycznym zarówno w PJS jak i zespołach guzów hamartomatycznych związanych z mutacjami PTEN. Rapamycyna była skuteczna w hamowaniu tworzenia się nowych polipów u myszy Lkb1-/-[10].
Histopatologiczny obraz polipów hamartomatycznych w PJS jest inny niż wszystkich pozostałych polipów jelita grubego, co przypuszczalnie wiąże się z odmiennym przebiegiem sekwencji patogenezy tych zmian. W polipach typu Peutza-Jeghersa obserwuje się wydłużone, palisadowato ułożone komórki nabłonka i torbielowate poszerzenia gruczołów jelitowych, nakładające się na drzewkowatą sieć włókien mięśniówki gładkiej. Wyraźne są niekiedy przepełnione śluzem komórki kubkowe i (bardzo charakterystyczna) pseudoinwazja histologicznie łagodnych komórek nabłonka poza błonę podstawną, w rzeczywistości będąca wyrazem błędnej organizacji warstw nabłonka (epithelial misplacement)[11][12]. Nie obserwuje się atypii komórek ani niskiego zróżnicowania, typowych dla gruczolaków, tak samo nie wykazuje się cech cytogenetycznych dysplastycznych gruczolaków w polipach PJS. Polipy hamartomatyczne w zespole polipowatości młodzieńczej (JPS, [OMIM#174900]) powstają w niewyjaśnionym mechanizmie jako skutek mutacji germinalnej genu SMAD4/DPC4, ale histologicznie są odmienne niż w PJS, a ryzyko nowotworzenia w tych dwóch zespołach też nie jest takie samo.
Sugerowano, że polipy tworzą się u pacjentów z PJS w miejscach powtarzanych urazów[13]. Opisano przypadek pacjenta z PJS bez polipowatości i współistniejącą łuszczycą, u którego plamista hiperpigmentacja występowała w niezwykłych lokalizacjach (kark, łokcie, potylica, pośladki), korelujących z wcześniejszymi miejscami blaszek łuszczycowych. Stąd przypuszczenie, że hiperpigmentacja również może być indukowana urazem lub stanem zapalnym, hamującym w nieznany sposób transport barwnika z melanocytów do keratynocytów[14].
Objawy kliniczne i przebieg
Cechą charakteryzującą zespół Peutza-Jeghersa są hamartomatyczne polipy w przewodzie pokarmowym, którym towarzyszy charakterystyczna pigmentacja skóry i błon śluzowych – mnogie plamy soczewicowate (lentiginosis). Polipy występują przede wszystkim w jelicie cienkim (64%, w kolejności występowania: jelito czcze > jelito kręte > dwunastnica), a także w okrężnicy (53%), żołądku (49%) i odbytnicy (32%)[15]. Donoszono również o obecności polipów w górnych (jama nosowa[16]) i dolnych drogach oddechowych, a także w pęcherzu moczowym[17] i moczowodzie[18].
Uważa się, że polipy hamartomatyczne nie wiążą się z dużym ryzykiem transformacji nowotworowej, wiążą się jednak z ryzykiem niedrożności. Zwykle mają długą szypułę i tendencję do autoamputacji, będącej źródłem krwawienia z przewodu pokarmowego[17].
W dużym badaniu na 222 pacjentach z PJS stwierdzono, że najczęstszą dolegliwością prowadzącą do rozpoznania choroby były zaparcia (42,8%), następnie ból brzucha (23,4%), krew w stolcu (13,5%) i uwypuklenie polipa odbytnicy przez kanał odbytu (7,2%). U 23% na właściwą diagnozę naprowadziły objawy dermatologiczne[15].
Plamy soczewicowate w zespole Peutza-Jeghersa mają ciemnoniebieską lub brązowawą barwę, i występują na skórze wokół warg, nosa, okolicy narządów płciowych, dłoni i stóp, oraz na błonie śluzowej policzków. Pigmentacja skóry wokół nosa, oczodołów, w okolicy narządów płciowych i odbytu często zanika po okresie dojrzewania[9]. Poza jamą ustną melanoza nie jest obserwowana w błonie śluzowej przewodu pokarmowego.
Zespół Peutza-Jeghersa należy do zespołów wrodzonej predyspozycji do rozwoju nowotworów. Prawie połowa pacjentów z zespołem Peutza-Jeghersa umiera z powodu choroby nowotworowej przed 57. rokiem życia. Kumulatywne ryzyko pojawienia się nowotworów złośliwych u pacjenta z PJS w wieku 65 lat wynosi prawie 93%[19]. Nowotwory spotykane u pacjentów z zespołem Peutza-Jeghersa to:
- rak jelita cienkiego
- rak jelita grubego
- rak żołądka
- rak trzustki
- rak sutka
- rak jajnika (zwłaszcza ziarniszczak[20]) występujący częściej niż nowotwory złośliwe jąder u chorych z zespołem Peutza-Jeghersa
- guzy z komórek sznurów płciowych (sex cord tumors with annular tubules, SCTAT)
- wysoko zróżnicowany gruczolakorak szyjki macicy (minimal deviation adenocarcinoma)
- wapniejące, hormonalnie czynne guzy jąder z komórek Sertolego.
Ryzyko względne rozwoju dowolnego typu nowotworu u pacjentów z PJS jest większe niż 15. Szczególnie wysokie jest ryzyko względne dla raka jelita cienkiego (520), żołądka (213), trzustki (132), okrężnicy (84) i przełyku (57), nieco mniejsze dla raka piersi (15,2), płuc (17) i jajnika (27)[19].
Pierwszym objawem guzów hormonalnie czynnych może być ginekomastia u mężczyzn spowodowana produkcją estrogenów przez guzy z komórek Sertolego i nieregularne krwawienia miesięczne u kobiet również mające związek z hiperestrogenizacją wywołaną guzami SCTAT, a także może wystąpić przedwczesne dojrzewanie u dziewczynek[21].
Rozpoznanie
Zaproponowano kryteria rozpoznania zespołu Peutza-Jeghersa[22]:
- U pacjentów z histopatologiczne potwierdzonymi hamartomatycznymi polipami jelita, pewna diagnoza zespołu może być postawiona po spełnieniu dwóch z trzech następujących kryteriów:
- Wywiad rodzinny wskazujący na dziedziczenie autosomalne dominujące
- Hiperpigmentacja skóry i śluzówek
- Polipowatość jelita cienkiego
- U pacjentów bez histopatologicznego potwierdzenia hamartomatycznych polipów jelita, wstępne rozpoznanie zespołu może być postawione na podstawie dwóch z trzech powyższych kryteriów.
- U pacjentów bez dodatniego wywiadu rodzinnego w kierunku PJS, rozpoznanie zależy od stwierdzenia ≥2 histopatologiczne potwierdzonych polipów[23].
- U pacjentów z krewnym I° z PJS, obecność hiperpigmentacji śluzówkowo-skórnej wystarcza do postawienia wstępnego rozpoznania zespołu.
Badania genetyczne
Częstość wykrywanych mutacji w przypadku dodatniego wywiadu rodzinnego wynosi około 100%, niezależnie od zastosowanej metody (sekwencjonowanie, metody wykrywania dużych delecji/duplikacji)[24]. Częstość wykrywanych mutacji w przypadku ujemnego wywiadu rodzinnego wykrywanych tymi metodami szacowana jest na około 91%. Potrzebne są dodatkowe badania potwierdzające tak wysoką skuteczność wykrywania mutacji; są dowody na związki PJS z innymi loci niż 19p13.3.
Rekomendowano badanie genetyczne w kierunku PJS u każdego pacjenta z typowym dla zespołu polipem lub pigmentacją wokół ust[25].
Różnicowanie
Diagnostyka różnicowa osiowych objawów w zespole Peutza-Jeghersa obejmuje:
Polipy przewodu pokarmowego:
- zespół młodzieńczej polipowatości (JPS)
- zespół mieszanej dziedzicznej polipowatości (MHPS)
- zespoły guzów hamartomatycznych związane z mutacjami PTEN
- dziedziczny rak jelita grubego niezwiązany z polipowatością (HNPCC)
- rodzinna polipowatość gruczolakowata
- kompleks Carneya
Melanoza skóry i śluzówek:
- zespół Laugiera-Hunzikera[26]
- reakcja na leki (neuroleptyki, środki antykoncepcyjne, minocyklina, zydowudyna, pochodne chininy)
- wariant normy, szczególnie częsty u Afroamerykanów[27]
a także:
Profilaktyka i leczenie
Zaproponowany w artykule z 2006 roku program badań profilaktycznych u pacjentów z postawionym rozpoznaniem zespołu Peutza-Jeghersa obejmuje[28].
U obu płci:
- Kolonoskopia co 2-3 lata począwszy od 18. roku życia
- Endoskopia górnego odcinka przewodu pokarmowego co 2-3 lata, począwszy od 8. roku życia
- ultrasonografia endoskopowa (EUS) i ewentualnie tomografia komputerowa lub oznaczenie CA 19-9 co 1-2 lata, od 25. roku życia
U kobiet:
- comiesięczne samobadanie piersi od 18. roku życia
- coroczna mammografia i MRI piersi i badanie lekarskie piersi co 6 miesięcy, od 25. roku życia
- coroczne USG przezpochwowe i oznaczenie CA-125, od 25. roku życia
- coroczny wywiad lekarski i badanie przedmiotowe w kierunku łagodnych guzów jajnika w okresie od urodzenia do 12. roku życia
- badanie ginekologiczne i cytologia począwszy od 21. roku życia
U mężczyzn:
- coroczny wywiad lekarski i badanie przedmiotowe w kierunku guzów jąder z komórek Sertolego, w okresie od urodzenia do 12. roku życia; do rozważenia USG jąder co 2 lata w tym okresie.
- Zalecane działania
- Wskazane są rutynowe badania endoskopowe i profilaktyczna polipektomia hamartomatycznych polipów jelita, zmniejszająca ryzyko powikłań niedrożnościowych[6]. Celem uniknięcia konieczności częstych laparotomii zaleca się diagnostykę przy pomocy endoskopii kapsułkowej[29][30] i enteroskopię „push and pull” (z podwójnym balonem)[31]. Skuteczna jest też śródoperacyjna endoskopia, umożliwiająca zbadanie całej długości jelita i umożliwiająca doszczętną polipektomię[32][33]
- W przypadku rozwoju nowotworu, postępowanie jest przyczynowe, takie jak u chorych ze sporadycznymi guzami[6].
- Hiperpigmentacja ust może stanowić problem natury psychologicznej dla pacjentów. Opisano leczenie tych zmian laserem rubinowym, z doskonałym rezultatem kosmetycznym, bez powikłań ani nawrotów[34][35][36].
- Mimo braku badań klinicznych, w piśmiennictwie zaleca się do rozważenia u pacjentek z rozpoznaniem PJS profilaktyczną histerektomię i obustronną salpingoooforektomię po 35. roku życia lub po urodzeniu planowanej liczby dzieci, przywołując korzyści tego działania u pacjentek z HNPCC[6].
Historia
Zespół zawdzięcza swoją nazwę dwóm lekarzom, którzy niezależnie od siebie opisali przypadki choroby. Pierwszy, w 1921 roku, opisał ją Johannes Laurentius Augustinus Peutz[37], a w 1949 roku zespół szczegółowo określili na łamach dwóch kolejnych numerów „New England Journal of Medicine” Harold Joseph Jeghers, Victor McKusick i K.H. Katz[38]. Termin zespołu Peutza użył jako pierwszy student Peutza, van Wijk, w swojej rozprawie doktorskiej[39], nazwę zespołu Peutza-Jeghersa zaproponował radiolog André J. Bruwer z Mayo Clinic w 1954 roku[40].
Opisy choroby pojawiały się w literaturze medycznej już wcześniej. Sir Jonathan Hutchinson w 1896 opisał bliźniaczki jednojajowe o nazwisku Howard (córki miejskiego szczurołapa), u których stwierdził charakterystyczną pigmentację błony śluzowej warg[41]. Jedna z nich zmarła w wieku 20 lat w Metropolitan Hospital wskutek wgłobienia, o czym doniósł Frederick Parkes Weber w artykule z 1919 roku[42]. Druga bliźniaczka zmarła na raka sutka w wieku 52 lat, o czym wspomniano w artykule przeglądowym Jeghersa i wsp.
Molekularne podstawy choroby poznano w 1998 roku, gdy dwa zespoły badaczy niezależnie od siebie przedstawiły wyniki swoich badań; praca Lauri Aaltonen i wsp. z Uniwersytetu w Helsinkach ukazała się 8 stycznia na łamach „Nature”, tydzień wcześniej w „Nature Genetics” opublikowano doniesienie grupy Dietera Jennego z Max-Planck-Institute of Neurobiology i Michaela Zimmera z Uniwersytetu w Würzburgu. Badacze fińscy nazwali gen LKB1, a zespół niemiecki STK11; jak dotąd nie ma konsensusu, której nazwy powinno się używać. Region kodujący LKB1 został sklonowany przez Jun-ichi Nezu z Chugai Pharmaceuticals w Japonii.
Rodzina opisana przez Jeghersa, znana w piśmiennictwie jako „rodzina z Harrisburga”, w której rozpoznano 12 przypadków choroby, jest najliczniejszą opisaną rodziną z PJS. W 1988 roku opublikowano pracę opisującą 49-letnią historię tej rodziny, objętej wszechstronną opieką lekarską; trzech członków rodziny zmarło w młodym wieku, u dziesięciu wykonano łącznie 75 zabiegów polipektomii[43]. W innej pracy z 1999 roku opisano sześć pokoleń holenderskiej rodziny opisanej przez Peutza 78 lat wcześniej. U członków rodziny zidentyfikowano mutację 66insT w genie LKB1[44].
Przypisy
- ↑ Kutscher AH, Zegarelli EV, Rankow RM, Slaughter TW. Incidence of Peutz–Jeghers syndrome. „Am J Dig Dis”. 5, s. 576–577, 1960. PMID: 14412980.
- ↑ Mallory SB, Stough DB. Genodermatoses with malignant potential. „Dermatol Clin”. 5. 1, s. 221–230, 1987. PMID: 3549077.
- ↑ Boudeau J, Sapkota G, Alessi DR. LKB1, a protein kinase regulating cell proliferation and polarity. „FEBS Lett”. 546. 1, s. 159–165, 2003. PMID: 12829253.
- ↑ Hemminki A, Markie D, Tomlinson I, Avizienyte E, Roth S, Loukola A, Bignell G, Warren W, Aminoff M, Hoglund P, Jarvinen H, Kristo P, Pelin K, Ridanpaa M, Salovaara R, Toro T, Bodmer W, Olschwang S, Olsen AS, Stratton MR, de la Chapelle A, Aaltonen LA. A serine/threonine kinase gene defective in Peutz-Jeghers syndrome. „Nature”. 391, s. 184–187, 1998. DOI: 10.1038/34432. PMID: 9428765.
- ↑ Jenne DE, Reimann H, Nezu J, Friedel W, Loff S, Jeschke R, Muller O, Back W, Zimmer M. Peutz-Jeghers syndrome is caused by mutations in a novel serine threonine kinase. „Nat Genet”. 18, s. 38–43, 1998. DOI: 10.1038/ng0198-38. PMID: 9425897.
- ↑ a b c d e Christopher I Amos, Marsha L Frazier, Thomas J McGarrity: Peutz-Jeghers Syndrome. GeneReviews. [dostęp 2007-12-15].
- ↑ Mehenni H, Blouin JL, Radhakrishna U, Bhardwaj SS, Bhardwaj K, Dixit VB, Richards KF, Bermejo-Fenoll A, Leal AS, Raval RC, Antonarakis SE. Peutz-Jeghers syndrome: confirmation of linkage to chromosome 19p13.3 and identification of a potential second locus, on 19q13.4. „Am J Hum Genet”. 61, s. 1327–1334, 1997. PMID: 9399902.
- ↑ Schumacher V, Vogel T, Leube B, Driemel C, Goecke T, Möslein G, Royer-Pokora B. STK11 genotyping and cancer risk in Peutz-Jeghers syndrome. „J Med Genet”. 42. 5, s. 428–435, 2005. PMID: 15863673.
- ↑ a b Zbuk KM, Eng C. Hamartomatous polyposis syndromes. „Nat Clin Pract Gastroenterol Hepatol”. 4. 9, s. 492-502, 2007. DOI: 10.1038/ncpgasthep0902. PMID: 17768394.
- ↑ Wei C, Amos CI, Zhang N, Wang X, Rashid A, Walker CL, Behringer RR, Frazier ML. Suppression of Peutz-Jeghers polyposis by targeting mammalian target of rapamycin signaling. „Clinical cancer research : an official journal of the American Association for Cancer Research”. 4 (14), s. 1167–1171, luty 2008. DOI: 10.1158/1078-0432.CCR-07-4007. PMID: 18281551.
- ↑ Petersen VC, Sheehan AL, Bryan RL, Armstrong CP, Shepherd NA. Misplacement of dysplastic epithelium in Peutz-Jeghers Polyps: the ultimate diagnostic pitfall?. „Am J Surg Pathol”. Jan;24. 1, s. 34–39, 2000. PMID: 10632485.
- ↑ Shepherd NA, Bussey HJ, Jass JR. Epithelial misplacement in Peutz-Jeghers polyps. A diagnostic pitfall. „Am J Surg Pathol”. 11. 10, s. 743–749, 1987. PMID: 3661821.
- ↑ Sommerhaug RG, Mason T. Peutz-Jeghers syndrome and ureteral polyposis. „JAMA: the journal of the American Medical Association”. 1 (211), s. 120–2, styczeń 1970. PMID: 5466889.
- ↑ Banse-Kupin LA, Douglass MC. Localization of Peutz-Jeghers macules to psoriatic plaques. „Archives of dermatology”. 6 (122), s. 679–83, czerwiec 1986. PMID: 3717978.
- ↑ a b Utsunomiya J, Gocho H, Miyanaga T, Hamaguchi E, Kashimure A. Peutz–Jeghers syndrome: its natural course and management. „Johns Hopkins Med J”. 136, s. 71–82, 1975. PMID: 1117595. PDF
- ↑ de Leng WW, Westerman AM, Weterman MA, Jansen M, van Dekken H, Giardiello FM, de Rooij FW, Paul Wilson JH, Offerhaus GJ, Keller JJ. Nasal polyposis in Peutz-Jeghers syndrome: a distinct histopathological and molecular genetic entity. „J Clin Pathol”. 60. 4, s. 392-6, 2007. DOI: 10.1136/jcp.2005.036418. PMID: 16775120.
- ↑ a b McGarrity TJ, Amos C. Peutz–Jeghers syndrome: clinicopathology and molecular alterations. „Cell Mol Life Sci”. 63, s. 2135–2144, 2006. DOI: 10.1007/s00018-006-6080-0. PMID: 16952058.
- ↑ Sommerhaug RG, Mason T. Peutz-Jeghers syndrome and ureteral polyposis. „JAMA”. 211, s. 120-122, 1970. PMID: 5466889. PDF
- ↑ a b Giardiello FM, Brensinger JD, Tersmette AC, Goodman SN, Petersen GM, Booker SV, Cruz-Correa M, Offerhaus JA. Very high risk of cancer in familial Peutz-Jeghers syndrome. „Gastroenterology”. 119. 6, s. 1447-53, 2000. PMID: 11113065.
- ↑ Christian CD, Mcloughlin TG, Cathcart ER, Eisenberg MM. Peutz-Jeghers syndrome associated with functioning ovarian tumor. „JAMA”. 190, s. 935-8, 1965. PMID: 14214503.
- ↑ Solh HM, Azoury RS, Najjar SS. Peutz-Jeghers syndrome associated with precocious puberty. „J Pediatr”. 103. 4, s. 593-5, 1983. PMID: 6620020.
- ↑ Giardiello FM, Welsh SB, Hamilton SR, Offerhaus GJ, Gittelsohn AM, Booker SV, Krush AJ, Yardley JH, Luk GD. Increased risk of cancer in the Peutz-Jeghers syndrome. „New England Journal of Medicine”. 316, s. 1511-4, 1987. PMID: 3587280.
- ↑ Tomlinson IP, Houlston RS. Peutz-Jeghers syndrome. „J Med Genet”. 34, s. 1007-11, 1997. PMID: 9429144.
- ↑ Aretz S, Stienen D, Uhlhaas S, Loff S, Back W, Pagenstecher C, McLeod DR, Graham GE, Mangold E, Santer R, Propping P, Friedl W. High proportion of large genomic STK11 deletions in Peutz-Jeghers syndrome. „Hum Mutat”. 26, s. 513-9, 2005. PMID: 16287113.
- ↑ Burt R, Neklason DW. Genetic testing for inherited colon cancer. „Gastroenterology”. 128, s. 1696-716, 2005. PMID: 15887160.
- ↑ Lampe AK, Hampton PJ, Woodford-Richens K, Tomlinson I, Lawrence CM, Douglas FS. Laugier-Hunziker syndrome: an important differential diagnosis for Peutz-Jeghers syndrome. „J Med Genet”. 40. 6, 2003. PMID: 12807976.
- ↑ Bishop P, Loftis S, Nowicki M. What syndrome is this? Peutz-Jeghers syndrome. „Pediatr Dermatol”. 21, s. 503-505, 2004. PMID: 15283802.
- ↑ Giardiello FM, Trimbath JD. Peutz-Jeghers syndrome and management recommendations. „Clin Gastroenterol Hepatol”. 4. 4, s. 408-15, 2006. PMID: 16616343.
- ↑ Brown G, Fraser C, Schofield G, Taylor S, Bartram C, Phillips R, Saunders B. Video capsule endoscopy in peutz-jeghers syndrome: a blinded comparison with barium follow-through for detection of small-bowel polyps. „Endoscopy”. 38. 4, s. 385-90, 2006. DOI: 10.1055/s-2006-925028. PMID: 16680639.
- ↑ Soares J, Lopes L, Vilas Boas G, Pinho C. Wireless capsule endoscopy for evaluation of phenotypic expression of small-bowel polyps in patients with Peutz-Jeghers syndrome and in symptomatic first-degree relatives. „Endoscopy”. 36. 12, s. 1060-6, 2004. DOI: 10.1055/s-2004-826038. PMID: 15578295.
- ↑ Pennazio M, Rossini FP. Small bowel polyps in Peutz-Jeghers syndrome: management by combined push enteroscopy and intraoperative enteroscopy. „Gastrointest Endosc”. 51. 3, s. 304-8, 2000. PMID: 10699775.
- ↑ Edwards DP, Khosraviani K, Stafferton R, Phillips RK. Long-term results of polyp clearance by intraoperative enteroscopy in the Peutz-Jeghers syndrome. „Dis Colon Rectum”. 46. 1, s. 48-50, 2003. DOI: 10.1097/01.DCR.0000044710.40026.4D. PMID: 12544521.
- ↑ Takehara H, Okada A, Nishi M, Masamune K, Komi N. Intra-operative total enteroscopy for the management of Peutz-Jegher's syndrome. „Acta Paediatr Jpn”. 34. 5, s. 569-72, 1992. PMID: 1442033.
- ↑ Kato S, Takeyama J, Tanita Y, Ebina K. Ruby laser therapy for labial lentigines in Peutz-Jeghers syndrome. „Eur J Pediatr”. 157. 8, s. 622-4, 1998. PMID: 9727843.
- ↑ DePadova-Elder SM, Milgraum SS. Q-switched ruby laser treatment of labial lentigines in Peutz-Jeghers syndrome. „J Dermatol Surg Oncol”. 20. 12, s. 830-2, 1995. PMID: 7798417.
- ↑ Chang CJ, Nelson JS. Q-switched ruby laser treatment of mucocutaneous melanosis associated with Peutz-Jeghers syndrome. „Ann Plast Surg”. 36. 4, s. 394-7, 1996. PMID: 8728583.
- ↑ Peutz JLA. Over een zeer meerkwaardige, gecombineerde familiaire polyposis van de slijmvliezen van den tractus intestinalis met die van de neuskeelholte en gepaard met eigenaardige pigmentaties van huid- en slijmvliezen. „Nederl Maandschr Geneesk”. 10, s. 134-146, 1921. PDF
- ↑ Jeghers H, McKusick VA, Katz KH. Generalized intestinal polyposis and melanin spots of the oral mucosa, lips and digits. „New England Journal of Medicine”. 241, s. 993–1005, 1031–1036, 1949. PMID: 15399020. PDF
- ↑ van Wijk TW: Over het syndroom polyposis adenomatosa gastro-intestinalis generalisata heredofamiliaris gecombineerd met huid- en slijmvliespigmentaties; of ziekte van Peutz. Leiden: University of Leiden, 1950.
- ↑ Bruwer A, Bargen JA, Kierland RR. Surface pigmentation and generalized intestinal polyposis; (Peutz-Jeghers syndrome). „Mayo Clin Proc”. 29, s. 168–71, 1954. PMID: 13145642. PDF
- ↑ Hutchinson J. Pigmentation of lip and mouth. „Archives of Surgery (London)”. 7, s. 290, 1896. PDF
- ↑ Weber FP. Patches of deep pigmentation of the oral mucous membrane not connected with Addison’s disease. „Quarterly Journal of Medicine (Oxford)”. 12, s. 204–208, 1919.
- ↑ Foley TR, McGarrity TJ, Abt AB. Peutz-Jeghers syndrome: a clinicopathologic survey of the „Harrisburg family” with a 49-year follow-up. „Gastroenterology”. 95. 6, s. 1535–40, 1988. PMID: 3181678.
- ↑ Westerman AM, Entius MM, de Baar E, Boor PP, Koole R, van Velthuysen ML, Offerhaus GJ, Lindhout D, de Rooij FW, Wilson JH. Peutz-Jeghers syndrome: 78-year follow-up of the original family. „Lancet”. 353. 9160. s. 1211-5. DOI: 10.1016/S0140-6736(98)08018-0. PMID: 10217080.
Linki zewnętrzne
- PEUTZ-JEGHERS SYNDROME; PJS w bazie Online Mendelian Inheritance in Man (ang.)
- SERINE/THREONINE PROTEIN KINASE 11; STK11 w bazie Online Mendelian Inheritance in Man (ang.)
- https://web.archive.org/web/20080117053141/http://www.jeghers.com/
- Christopher I Amos, Marsha L Frazier, Thomas J McGarrity: Peutz-Jeghers Syndrome. GeneReviews.
- Video Capsule Endoscopy – Polyp in Peutz Jegher's Syndrome, Small Intestine. The DAVE Project. daveproject.org. [zarchiwizowane z tego adresu (2008-03-07)]. Endoskopowy obraz polipa hamartomatycznego u pacjenta z PJS.
- Peutz-Jeghers syndrome. Geneva Foundation for Medical Education and Research. [dostęp 2007-12-16]. [zarchiwizowane z tego adresu (2007-10-18)].
- Andrea Duchini, John M Carethers: Peutz-Jeghers Syndrome. eMedicine Gastroenterology.
- Peutz-Jeghers Syndrome. The Johns Hopkins Guide for Patients and Families. Johns Hopkins Medicine, 2001.
- Peutz-Jeghers syndrome w bazie Who Named It (ang.)
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Jong-Ha Yoo et al, Licencja: CC BY 2.0
Pathologic findings of the Peutz-Jeghers polyp. The colonic polyp shows hyperplastic mucosal epithelium and arborizing pattern of smooth muscle, consistent with a hamartomatous polyp (en:Hematoxylin-eosin stain, 200x).
(c) robhengxr of Flickr, CC BY 2.0
Note multiple polyps (mostly pedunculated) and at least one large mass at the hepatic flexure coated with contrast.
Autor: Abdullah Sarhan, Licencja: CC BY-SA 4.0
melanotische Pigmentflecken bei einem Jungen mit Peutz-Jeghers-Syndrom
Autor: Filip em, Licencja: CC BY 2.0
Main metabolic pathways involved in hamartoma predisposition syndromes (PJS: Peutz-Jeghers syndrome; CS/BRRS - Cowden syndrome/Bannayan-Ruvalcaba-Riley syndrome; TSC - tuberous sclerosis complex. PI3K – phosphoinositol kinase, PIP3 – phosphatidylinositol-3,4,5-triphosphate; PIP2 – phosphatidylinositol-4,5-bisphosphate; PTEN - phosphatase and tensin homolog; TSC1 and TSC2 - hamartin/tuberin complex; mTOR - mammalian target of rapamycin. Therapeuthic potential of rapamycin and other inhibitors of mTOR signalling is presented
Drawing from 1896 publication of twins thought to have Peutz-Jeghers Syndrome