Zespół delecji 22q11.2
| ||
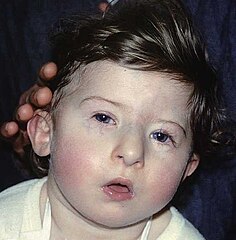 Dziecko z rozpoznaniem zespołu DiGeorge'a | ||
| ICD-10 | D82.1 Zespół Di George’a | |
| DiseasesDB | 3631 | |
| OMIM | 188400 | |
| MeSH | D004062 | |

Zespół delecji 22q11.2 (inaczej zespół DiGeorge'a albo zespół mikrodelecji 22q11, ang. 22q11.2 deletion syndrome) – zespół wad wrodzonych spowodowany mikrodelecją prążka chromosomu 22q11 przebiegający z pierwotnym niedoborem odporności.
W zespole delecji 22q11.2 dochodzi do zaburzeń rozwoju grasicy i jej aplazji, najczęściej w 6.–10. tygodniu życia płodowego. Grasica rozwija się z III i IV kieszonki skrzelowej, więc zaburzenia jej rozwoju przebiegają wspólnie z zaburzeniami gruczołów przytarczycznych.
Historia
Historycznie opisano kilka zespołów wad wrodzonych, które z czasem okazały się stanowić spektrum jednego zespołu wad. Były to:
- wrodzona hipoplazja grasicy skojarzona z hipokalcemią
- zespół DiGeorge’a, opisany przez Angelo Di George’a w 1968[1].
- zespół Takao (conotruncal anomaly face syndrome)
- zespół podniebienno-sercowo-twarzowy (velocardiofacial syndrome, VCFS, zespół Shprintzena)
- zespół czaszkowo-twarzowy Caylera
- niektóre przypadki zespołu Opitza G/BBB
- zespół CATCH-22
Akronim CATCH-22 (ang. Paragraf 22) oznaczał:
- C = wady serca (cardiac defects)
- A = dysmorfia twarzy (abnormal facies)
- T = hipoplazja grasicy (thymic hypoplasia)
- C = rozszczep podniebienia (cleft palate)
- H = hipokalcemia wtórna do aplazji przytarczyc (hypocalcemia from parathyroid aplasia)
- 22 = mikrodelecje 22 chromosomu.
Obecnie zaleca się niestosowanie terminu CATCH22 z powodu pejoratywnego wydźwięku nazwy[2]: tytuł powieści Hellera Paragraf 22 jest też określeniem sytuacji bez wyjścia.
Epidemiologia
Zespół delecji 22q11.2 występuje w 1 na 4 000 żywych urodzeń w Szwecji[3]. Zespół może być jednak częstszy ze względu na to, że niektórzy ludzie mają niewiele objawów i mogli zostać niezdiagnozowani.
Objawy
Objawy są zmienne i obejmują:
- wrodzone wady serca (75%)
- tetralogia Fallota
- atrezja tętnicy płucnej z ubytkiem przegrody międzykomorowej
- truncus arteriosus
- przerwanie łuku aorty typu B (30%)
- ubytek przegrody międzyprzedsionkowej
- zaburzenia rozwoju podniebienia (69%)
- trudności w uczeniu (70-90%)
- pierwotny niedobór odporności (77%) spowodowany aplazją grasicy, co powoduje hipoplazję limfocytów T, laboratoryjnie charakteryzującą się znacznym wzrostem odsetka limfocytów B nad limfocytami T i areaktywnością w teście transformacji blastycznej. W związku z powyższym choroba przebiega z wzmożoną zapadalnością na choroby wirusowe, bakteryjne i grzybicze. Jej objawy pojawiają się w pierwszych 6 miesiącach życia
- hipokalcemię (średnio 30%) spowodowaną niedorozwojem gruczołów przytarczycznych. Rozpoznawana u 69–72% pacjentów z fenotypem zespołu DiGeorge’a, 13-22% pacjentów z fenotypem VCFS, 10% z CAFS, 49–60% z 22q11.2 del
- wrodzone wady nerek[4]
- trudności z karmieniem
- choroby autoimmunologiczne, takie jak reumatoidalne zapalenie stawów (150 razy większe ryzyko), niedokrwistość hemolityczna autoimmunologiczna, idiopatyczna plamica małopłytkowa, autoimmunologiczne enteropatie (choroba trzewna), bielactwo
- zwiększone ryzyko zachorowania na choroby psychiczne[5], w tym około 30-krotnie podwyższone ryzyko zachorowania na schizofrenię (wśród chorych na schizofrenię w 0,5% do 3% przypadków stwierdza się zespół mikrodelecji 22q11, podczas gdy w populacji ogólnej rozpowszechnienie zespołu mikrodelecji 22q11 wynosi 0,025%)[6][7].
Przypisy
- ↑ DiGeorge AM. Congenital absence of the thymus and its immunologic consequences: concurrence with congenital hypoparathyroidism. White Plains, NY: March of Dimes-Birth Defects Foundation IV(1): 116-21. 1968
- ↑ Burn J: Closing time for CATCH22. J Med Genet 36:737–738, 1999
- ↑ Oskarsdóttir S, Vujic M, Fasth A. Incidence and prevalence of the 22q11 deletion syndrome: a population-based study in Western Sweden. „Arch Dis Child”. 89. 2, s. 148-51, 2004. PMID: 14736631.
- ↑ Lopez-Rivera E, Liu YP, Verbitsky M et al.. Genetic Drivers of Kidney Defects in the DiGeorge Syndrome. „N Engl J Med.”, 2017 Jan 25. DOI: 10.1056/NEJMoa1609009. PMID: 28121514 (ang.).
- ↑ M. Debbané, B. Glaser, MK. David, C. Feinstein i inni. Psychotic symptoms in children and adolescents with 22q11.2 deletion syndrome: Neuropsychological and behavioral implications.. „Schizophr Res”. 84 (2-3), s. 187-93, Jun 2006. DOI: 10.1016/j.schres.2006.01.019. PMID: 16545541.
- ↑ A. Horowitz, S. Shifman, N. Rivlin, A. Pisanté i inni. A survey of the 22q11 microdeletion in a large cohort of schizophrenia patients.. „Schizophr Res”. 73 (2-3), s. 263-7, Mar 2005. DOI: 10.1016/j.schres.2004.02.008. PMID: 15653270.
- ↑ AS. Bassett, EW. Chow, P. AbdelMalik, M. Gheorghiu i inni. The schizophrenia phenotype in 22q11 deletion syndrome.. „Am J Psychiatry”. 160 (9), s. 1580-6, Sep 2003. DOI: 10.1176/appi.ajp.160.9.1580. PMID: 12944331. PMCID: PMC3276594.
Linki zewnętrzne
- DIGEORGE SYNDROME; DGS w bazie Online Mendelian Inheritance in Man (ang.)
- DiGeorge's syndrome w bazie Who Named It (ang.)
- Donna M McDonald-McGinn, Beverly S Emanuel, Elaine H Zackai. 22q11.2 Deletion Syndrome GeneReviews
- Grupa wsparcia dla rodziców dzieci z zespołem Di George’a (pol.)
- Iftikhar Hussain. DiGeorge Syndrome eMedicine
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Prof Victor Grech, Licencja: CC BY-SA 3.0
A patient with DiGeorge syndrome, showing characteristic facial appearance, with tubular nose and carp-shaped mouth
Autor: Adriano R Tonelli1 , Kalyan Kosuri1 , Sainan Wei2 and Davoren Chick1, Licencja: CC BY 2.0
Figure 2. Result of FISH analysis using LSI probe (TUPLE 1) from DiGeorge/velocardiofacial syndrome critical region. TUPLE 1 (HIRA) probe was labeled in Spectrum Orange and Arylsulfatase A (ARSA) in SpectrumGreen as control. Absence of the orange signal indicates deletion of the TUPLE 1 locus at 22q11.2. Tonelli et al. Journal of Medical Case Reports 2007 1:167 doi:10.1186/1752-1947-1-167


