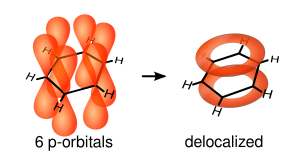Związki aromatyczne
Związki aromatyczne – związki chemiczne, z reguły organiczne, posiadające w cząsteczce zdelokalizowane elektrony π, tworzące tzw. układ aromatyczny. Zapewnia on cząsteczce dużo większą trwałość niż należałoby oczekiwać dla związku zawierającego wiązania podwójne.
Warunki aromatyczności:
- budowa pierścieniowa
- płaska cząsteczka (atomy węgla o hybrydyzacji sp2)
- 4n+2 zdelokalizowanych elektronów, gdzie n – liczba naturalna (tzw. reguła Hückla; obowiązuje dla n=0–5[1])
Problem struktury związków aromatycznych pojawił się, gdy zaobserwowano ich właściwości bardzo odbiegające od przewidzianych na podstawie wzorów strukturalnych. Były bardzo trwałe, nie reagowały w reakcji addycji, ulegały natomiast substytucji. By wyjaśnić te właściwości, zaproponowano, że wiązania podwójne w pierścieniu zlewają się ze sobą, tworząc jedną zdelokalizowaną chmurę elektronową. Żaden z tworzących ją elektronów nie jest przypisany do konkretnego atomu węgla. Budowę opisuje teoria rezonansu, zgodnie z którą budowy cząsteczki (rozmieszczenia w niej elektronów) nie można opisać jednym wzorem, jest ona zaś hybrydą (formą pośrednią) kilku różnych form różniących się jedynie rozmieszczeniem elektronów.
Najprostszy przedstawiciel obojętnych węglowodorów aromatycznych to benzen, w którym zdelokalizowane elektrony π pochodzą z układu trzech sprzężonych wiązań podwójnych. Najmniejszymi cząsteczkami aromatycznymi są trójatomowe pierścienie kationów cyklopropenylowych, zawierające dwa elektrony zdelokalizowane (n = 0 w regule Hückla). Zostały one przewidziane teoretycznie w roku 1952[2], a pierwszy związek tego typu (trwały, krystaliczny fluoroboran 1,2,3-trifenylcyklopropenylowy) otrzymał Ronald Breslow w 1957[3]. W 1970 Breslow (wraz z Johnem T. Grovesem) otrzymał kilka soli niepodstawionego kationu cyklopropenylowego[4]. Najprostszym przedstawicielem anionowych związków aromatycznych jest jon cyklopentadienylowy, występujący np. w ferrocenie.
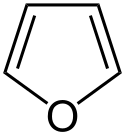
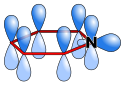
W związkach heterocyklicznych jedna ze zdelokalizowanych par elektronowych może pochodzić w całości od heteroatomu, np. w cząsteczce furanu cztery elektrony π pochodzą z dwóch sprzężonych wiązań podwójnych, a dwa elektrony π pochodzą z wolnej pary elektronowej atom tlenu. Natomiast w pirydynie atom azotu dostarcza tylko jednego elektronu π.
Związki zbudowane z wielu skondensowanych pierścieni aromatycznych znane są jako wielopierścieniowe węglowodory aromatyczne (PAH).
Przykładem nieorganicznego związku aromatycznego jest borazol.
Przypisy
- ↑ Hückel (4n + 2) rule, [w:] A.D. McNaught, A. Wilkinson, Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.H02867, ISBN 0-9678550-9-8 (ang.).
- ↑ John D. Roberts, Andrew Streitwieser Jr., Clare M. Regan. Small-Ring Compounds. X. Molecular Orbital Calculations of Properties of Some Small-Ring Hydrocarbons and Free Radicals. „J. Am. Chem.Soc.”. 74 (18), s. 4579–4582, 1952. DOI: 10.1021/ja01138a038.
- ↑ Ronald Breslow. Synthesis of the s-triphenylcyclopropenyl cation. „J. Am. Chem. Soc.”. 79 (19), s. 5318, 1957. DOI: 10.1021/ja01576a067.
- ↑ Ronald Breslow, John T. Groves. Cyclopropenyl cation. Synthesis and characterization. „J. Am. Chem. Soc.”. 92 (4), s. 984–987, 1970. DOI: 10.1021/ja00707a040.
Bibliografia
- Robert T. Morrison, Robert N. Boyd: Chemia organiczna. T. 1-2. Warszawa: PWN, 1985, s. 391-395. ISBN 83-01-04166-8.
Media użyte na tej stronie
Autor: Vladsinger, Licencja: CC BY-SA 3.0
Orbital hybridization in benzene rings.
Structure of furan
Autor: Sponk (talk), Licencja: CC BY 3.0
Schematic representation of the orbitals of a pyridine molecule