Związki fosforoorganiczne
Związki fosforoorganiczne – organiczne związki chemiczne zawierające wiązanie węgiel–fosfor[1], na przykład fosfoniany lub fosfiny. Nazwą tą często obejmuje się także estry fosforanowe[2][3], mimo że nie zawierają one wiązania P−C. Definicja związku fosforoorganicznego nie jest więc jednoznaczna. W chemii przemysłowej za związki fosforoorganiczne uważa się substancje zawierające w swojej cząsteczce fragment organiczny, nie jest zaś konieczne występowanie wiązania chemicznego pomiędzy węglem a fosforem.
Ponieważ fosfor jest w stanie przyjmować różne stopnie utlenienia, fakt ten został wykorzystany do utworzenia zwyczajowego podziału związków fosforoorganicznych na zawierające fosfor(V) lub fosfor(III). Mimo że jest to wygodna klasyfikacja (zawiera się w niej większość związków fosforoorganicznych), nie wyczerpuje ona wszystkich możliwych klas tych związków – dlatego utworzono kompletny system nomenklatury bazujący na dwóch parametrach: liczbie koordynacyjnej δ (wskazującej ile ligandów jest związanych z centralnym atomem fosforu) oraz liczbie walencyjnej λ.
Podstawowe klasy związków fosforoorganicznych pięciowiązalnych (fosforanoorganicznych)
W tej grupie związków charakterystyczna jest obecność formalnie podwójnego wiązania P=X (gdzie X to atom tlenowca, na przykład grupa fosforylowa P=O) oraz trzech ligandów połączonych z atomem fosforu wiązaniami pojedynczymi. Pięciowiązalny atom fosforu oznacza się symbolem λ5[4].
Kwasy fosforowe i ich estry
Wzór ogólny związków w tej grupie to X=P(YR)3 (gdzie X to atom tlenowca, Y to tlenowiec lub azot, a R to grupa organiczna lub wodór), na przykład estry kwasu fosforowego o wzorze ogólnym O=P(OR)3. Z powodu braku wiązania P-C z formalnego punktu widzenia nie są one związkami fosforoorganicznymi, a jedynie estrami lub amidami kwasu fosforowego i jego pochodnych. Najczęściej są one otrzymywane poprzez alkoholizę tlenochlorku fosforu. Związki tego rodzaju często występują w naturze, przykładem mogą być nukleotydy i kwasy nukleinowe, fosfolipidy budujące błonę komórkową oraz fosforany sacharydów odgrywające znaczącą rolę w procesach metabolicznych, między innymi w glikolizie. Istnieje także wiele związków zawierających grupę tiofosforylową P=S (rzadko spotykane w naturze).
 Przykłady związków fosforanoorganicznych: fosfatydylocholina, malation, cyklofosfamid, trifenylofosforan i ditiofosforan cynku
Przykłady związków fosforanoorganicznych: fosfatydylocholina, malation, cyklofosfamid, trifenylofosforan i ditiofosforan cynku
Fosfoniany, fosfiniany, kwasy fosfonowe, kwasy fosfinowe i ich pochodne
Wzór ogólny fosfonianu może zostać przedstawiony jako R-P(=O)(OR')2. Związki te znalazły wiele zastosowań jako herbicydy, leki na osteoporozę oraz gazy bojowe o charakterze neurotoksyn. Fosfiniany zawierają natomiast dwa wiązania P-C, wiele związków z tej klasy to herbicydy. Obecnie najczęściej spotykaną metodą otrzymywania fosfonianów jest reakcja Michaelisa-Arbuzowa. Związki te mają duże znaczenie w syntezie organicznej. W reakcji Hornera-Wadswortha-Emmonsa, będącej modyfikacją powszechnie znanej reakcji Wittiga, stosuje się je do rozbudowy szkieletu węglowego cząsteczki. Ponieważ wiązanie pomiędzy fosforem a węglem jest bardzo stabilne, produktami hydrolizy tych związków są pochodne odpowiednich kwasów fosfonowych lub fosfinowych, ale nigdy fosforany.
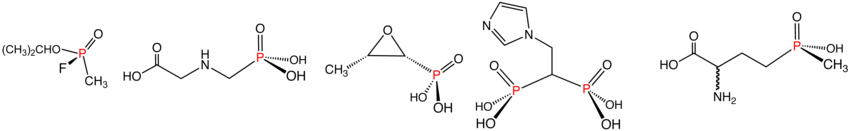 Wybrane fosfoniany organiczne i ich pochodne: sarin, dimetylometylofosfonian, Roundup, fosfomycyna, kwas zoledronowy i glufozynian
Wybrane fosfoniany organiczne i ich pochodne: sarin, dimetylometylofosfonian, Roundup, fosfomycyna, kwas zoledronowy i glufozynian
Tlenki fosfin i pokrewne związki z wiązaniem N-P
Tlenki fosfin mogą zostać przedstawione jako R3P=O, gdzie formalny stopień utlenienia atomu fosforu wynosi +I. Z uwagi na skłonność do tworzenia wiązań wodorowych wiele tych związków jest rozpuszczalnych w wodzie. Wiązanie P=O jest znacznie spolaryzowane, co prowadzi do wystąpienia znacznego momentu dipolowego (w przypadku tlenku trifenylofosfiny wartość momentu dipolowego wynosi 4,51 D. Do związków pokrewnych tlenkom fosfin zalicza się fosforoimidy (R3P=NR') oraz różnego rodzaju chalkogenidy postaci: (R3P=X, X = S, Se, Te). Związki z tych klas są stabilne termicznie, niektóre z nich znajdują ponadto zastosowania praktyczne.
Podstawowe klasy związków fosforoorganicznych trójwiązalnych
W tej grupie związków fosforoorganicznych charakterystyczna jest obecność wolnej pary elektronowej na atomie fosforu (oznaczanej P:) oraz trzech ligandów połączonych z atomem fosforu wiązaniami pojedynczymi. Trójwiązalny atom fosforu oznacza się symbolem λ3[4].
Sole fosfoniowe i fosfiny
Podstawowym związkiem w tej grupie organicznych pochodnych fosforu jest fosfan, nazywany zwyczajowo fosforowodorem. Zamiana jednego lub więcej atomów wodoru w cząsteczce tej substancji prowadzi do powstania fosfiny organicznej.
 Przegląd związków fosforoorganicznych pokrewnych fosfinom: kompleks zawierający ligand chelatowy będący chiralną difosfiną, mający zastosowanie w katalizie homogenicznej, pierwszorzędowa fosfina PhPH2, i związek fosforu (I)(PPh)5.
Przegląd związków fosforoorganicznych pokrewnych fosfinom: kompleks zawierający ligand chelatowy będący chiralną difosfiną, mający zastosowanie w katalizie homogenicznej, pierwszorzędowa fosfina PhPH2, i związek fosforu (I)(PPh)5.
Sole fosfoniowe stanowią odpowiednik soli amoniowych, w których azot znajduje się na +III stopniu utlenienia. Ogólny wzór dla tej klasy związków może zostać zapisany jako [PR4+]X-. Aniony tych soli posiadają geometrię piramidy tetragonalnej. Sole fosfoniowe nie są tak rozpowszechnione w przyrodzie jak sole amoniowe, nie znajdują też tak szerokiego zastosowania. Mimo tego są często używane w syntezie organicznej jako substraty do otrzymywania ylidów fosforowych używanych w reakcji Wittiga.
Fosforyny, fosfoniny i fosfininy
Wzory ogólne:
- fosforyny: P(OR)3
- fosfoniny: R-P(OR)2
- fosfininy: R2POR
- gdzie R to dowolne grupy organiczne
Fosforyny to triestry kwasu fosforawego. Otrzymuje się je zazwyczaj na drodze alkoholizy trichlorku fosforu:
- PCl3 + 3 ROH → P(OR)3 + 3 HCl
Związki te stanowią substraty w reakcji Arbuzowa, a także mogą stanowić ligandy w wielu związkach kompleksowych metali przejściowych. Związkami pośrednimi pomiędzy fosforynami a fosfinami są fosfoniny oraz fosfininy. Takie związki powstają na drodze alkoholizy odpowiednio chlorków kwasowych, których schematyczne wzory można odpowiednio przedstawić jako(PClR'2) oraz PCl2R'.
Fosfoalkeny i fosfoalkiny
Związki zawierające wielokrotne wiązania pomiędzy węglem a fosforem trójwiązalnym nazywane są fosfoalkenami (R2C=PR) oraz fosfoalkinami (RC≡PR). Podstawowa metoda syntezy fosfoalkenów polega na przeprowadzeniu 1,2-eliminacji odpowiedniego prekursora. Reakcja jest wywoływana przez wysoką temperaturę lub silnie nukleofilowe zasady takie jak DBU, DABCO lub trietyloamina:
Termoliza Me2PH prowadzi do uzyskania CH2=PMe. Tego rodzaju związki zawierające wielokrotne wiązania C−P są stosunkowo rzadkie i nie zostały one jeszcze dobrze zbadane.
Pestycydy fosforoorganiczne
Pestycydy na bazie organicznych związków fosforu działają w ten sam sposób jak broń chemiczna na nich oparta – blokują działanie jednego z enzymów, acetylocholinoesterazy (podobnie działają również pestycydy na bazie karbaminianów). Działanie to polega na nieodwracalnej inaktywacji AChE, która jest niezbędna do działania układu nerwowego owadów, ludzi oraz innych zwierząt.
Pestycydy te bardzo szybko ulegają degradacji poprzez hydrolizę podczas ekspozycji na warunki atmosferyczne, jednak ich śladowe ilości wciąż są wykrywane na przykład w żywności, czy wodzie pitnej. Ich pozorna zdolność do biodegradacji czyni je atrakcyjną alternatywą dla trwałych chemicznie pestycydów chloroorganicznych jak ddt, aldryna, dieldryna. Mimo szybszej degradacji, pestycydy fosforoorganiczne wykazują dużą większą toksyczność w porównaniu z chloroorganicznymi, co stanowi ryzyko dla ludzi narażonych na ich działanie.
Pospolicie używane pestycydy fosforoorganiczne to paration, malation, paration metylowy, chloropiryfos, diazinon, dichlorwos, fosmet, fenitrotion[5], tetrachlorwinfos, azametyfos i azynofos metylowy.
Efekty zdrowotne
Ekspozycja długotrwała
Powtarzająca się lub długotrwała ekspozycja na pestycydy fosforoorganiczne jest potencjalnie groźna dla zdrowia i może prowadzić do takich samych efektów jak jednorazowe narażenie na kontakt z dużymi ilościami tych substancji. Potencjalnie mogą też występować skutki opóźnione w czasie. Udokumentowane efekty zdrowotne u pracowników mających częsty kontakt z tym rodzajem pestycydów obejmują: osłabienie pamięci i koncentracji, dezorientację, poważną depresję, drażliwość, bóle głowy, zaburzenia mowy, opóźnienie czasu reakcji, koszmary, lunatyzm, senność lub bezsenność. Występują również objawy grypopodobne.
Ekspozycja na małe dawki
Nawet w relatywnie małych stężeniach pestycydy fosforoorganiczne mogą być niebezpieczne dla zdrowia. Pestycydy te są w stanie oddziaływać z szerokim spektrum substancji chemicznych występujących w mózgu, związanych na przykład z występowaniem ADHD, co jest szczególnie niebezpieczne u niemowląt i dzieci, których rozwój neurologiczny zależy od sekwencji następujących po sobie zdarzeń biochemicznych, których kolejność musi być ściśle zachowana[6] Związki fosforoorganiczne mogą być wchłanianie przez skórę, drogą wziewną przez płuca, a także wraz z pokarmem. Zgodnie z wydanym w 2008 roku raportem amerykańskiego Departamentu Rolnictwa ślady pestycydów fosforoorganicznych wykryto w 28% mrożonych jagód, 20% selera, 27% zielonej fasoli, 17% brzoskwiń, 8% brokułów i 25% truskawek[7].
Agencja Ochrony Środowiska USA umieściła pestycyd fosforoorganiczny paration na liście związków potencjalnie karcynogennych[8].
Jednym z powszechnych efektów zdrowotnych u osób narażonych na kontakt z tymi pestycydami jest występowanie chronicznego zmęczenia. Związek pomiędzy ekspozycją a wspomnianym wyżej efektem zdrowotnym został potwierdzony przez badania z 2003 roku[9].
Badania z 2007r wskazują na związek pomiędzy kontaktem z insektycydem chlorpirynfosem a spadkiem zdolności do nauki, zmniejszoną koordynacją ruchową i zaburzeniami behawioralnymi u dzieci, szczególnie z ADHD[10].
Dieta oparta na produktach organicznych i ekologicznych jest efektywnym sposobem na zmniejszenia narażenia na pestycydy. Metabolity związków fosforoorganicznych badane w moczu dzieci są poniżej progu detekcji podczas stosowania diety organicznej[11].
Badania przeprowadzone w 2010 wskazują na związek pomiędzy ekspozycja na pestycydy fosforoorganiczne a zwiększeniem ryzyka wystąpienia choroby Alzheimera[12]. Inne badania wskazują że dziesięciokrotne zwiększenie stężenia pozostałości pestycydów w moczu prowadzi do zwiększenia przypadków wystąpienia ADHD u dzieci o 55 do 72%.[13][14][7] Naukowcy badali stężenie związków fosforoorganicznych w moczu ponad 1100 dzieci w wieku 8-15 lat i jednoznacznie stwierdzili, że te u których wykryto duże stężenie fosforanów dialkilowych (które są produktami rozkładu pestycydów fosforoorganicznych) są znacznie bardziej narażone na wystąpienie ADHD. Ten efekt występuje nawet dla skrajnie małych stężeń związków fosforoorganicznych – dzieci u których wykryto jakiekolwiek wykrywalne ślady pestycydów zapadały na ADHD dwa razy częściej niż te, u których stężenie tych związków było poniżej granicy wykrywalności.
Dodatkowo wykazano, że nawet narażenie na związki fosforoorganiczne podczas życia płodowego prowadzi do częstszego występowania zaburzeń uwagi w późniejszych latach[15].
Badania z 2012 roku opublikowane w Environmental Health Perspectives pokazują, że prenatalny kontakt z pestycydami fosforoorganicznymi ma znaczący wpływ na masę noworodków oraz czas porodu. 10 krotne zwiększenie stężenia związków fosforoorganicznych u matki skutkuje wystąpieniem przedwczesnego porodu (średnio o pół tygodnia) i spadkiem wagi porodowej o średnio 151 gram. Dieta i przydomowe użycie pestycydów zostały zidentyfikowane jako główny sposób narażenia na związki fosforoorganiczne u osób niezwiązanych z rolnictwem. Badacze wskazują również, że przestawienie się na dietę opartą o warzywa ekologiczne już po kilku dniach obniża stężenie związków fosforoorganicznych poniżej limitu wykrywalności, co w jasny sposób wskazuje spożywanie produktów z rolnictwa przemysłowego jako drogę ekspozycji na pestycydy fosforoorganiczne. "[16]
Propozycje ograniczeń w stosowaniu
Zgodnie z danymi organizacji pozarządowej Pesticide Action Network pestycyd fosforoorganiczny o nazwie Paration jest jednym z najgroźniejszych środków ochrony roślin[17]. W samym USA ponad 650 rolników uległo zatruciu tą substancja od 1966 roku, z czego 100 zmarło. Sytuacja przedstawia się jeszcze gorzej w krajach mniej rozwiniętych. Światowa Organizacja Zdrowia, Polska Akademia Nauk i wiele innych organizacji działających na rzecz ochrony środowiska proponują wprowadzenie ogólnoświatowego zakazu stosowania parationu. Jak dotąd jego użycie jest zakazane bądź ograniczone w 23 krajach, a import jest nielegalny w 50 krajach [21]. W USA użycie parationu zostało zakazane w 2000 roku[18].
Inny pestycyd fosforoorganiczny, diazinon, zanim został zakazany był użyty w ilości ponad pół miliona kilogramów w samej tylko Kalifornii w 2000 roku[19].
W maju 2006 roku EPA dokonała ponownej oceny użycia dichlorfosu i zaproponowała kontynuację jego użycia pomimo obaw o bezpieczeństwo oraz dowodów wskazujących na jego rakotwórczość i szkodliwość dla mózgu i systemu nerwowego. Ekolodzy wskazują, że decyzje te zostały podjęte podczas zakulisowych nacisków i porozumień pomiędzy producentami pestycydów a politykami[20].
W 2001 roku EPA wprowadziła nowe restrykcje dotyczące użycia dwóch rodzajów pestycydów fosforoorganicznych: fosmetu i metyloazinfosu w celu zwiększenia ochrony osób zatrudnionych w rolnictwie[21].
Przypisy
- ↑ Organophosphorus reagents. A practical approach in chemistry. Patrick J. Murphy (red.). Oxford: Oxford University Press, 2004, s. 1. ISBN 0-19-850262-1. [dostęp 2018-05-24].
- ↑ J.N. Li i inni, What are the pKa values of organophosphorus compounds?, „Tetrahedron”, 18 (62), 2006, s. 4453-4462, DOI: 10.1016/j.tet.2006.02.049 (ang.).c?
- ↑ fosforoorganiczne związki, [w:] Encyklopedia PWN [online] [dostęp 2018-05-24].
- ↑ a b J. Stawinski, A. Kraszewski, How to get the most out of two phosphorus chemistries. Studies on H-phosphonates, „Accounts of Chemical Research”, 35 (11), 2002, s. 952-960, DOI: 10.1021/ar010049p, PMID: 12437320 (ang.).
- ↑ Extoxnet Pip - Fenitrothion, extoxnet.orst.edu [dostęp 2017-11-28].
- ↑ Metapress | Discover More, versita.metapress.com [dostęp 2017-11-28] [zarchiwizowane z adresu 2012-07-17] (ang.).
- ↑ a b Study: ADHD linked to pesticide exposure - CNN.com, www.cnn.com [dostęp 2017-11-28] (ang.).
- ↑ Integrated Risk Information System | US EPA, www.epa.gov [dostęp 2017-11-28] (ang.).
- ↑ N. Tahmaz, A. Soutar, J.W. Cherrie, Chronic fatigue and organophosphate pesticides in sheep farming: a retrospective study amongst people reporting to a UK pharmacovigilance scheme, „The Annals of Occupational Hygiene”, 47 (4), 2003, s. 261–267, DOI: 10.1093/annhyg/meg042, PMID: 12765866 (ang.).
- ↑ Zarchiwizowana kopia. [dostęp 2013-03-09]. [zarchiwizowane z tego adresu (2010-05-21)].
- ↑ Chensheng Lu i inni, Organic diets significantly lower children's dietary exposure to organophosphorus pesticides, „Environmental Health Perspectives”, 114 (2), 2006, s. 260–263, DOI: 10.1289/ehp.8418, PMID: 16451864, PMCID: PMC1367841 (ang.).
- ↑ K.M. Hayden i inni, Occupational exposure to pesticides increases the risk of incident AD: the Cache County study, „Neurology”, 74 (19), 2010, s. 1524–1530, DOI: 10.1212/WNL.0b013e3181dd4423, PMID: 20458069, PMCID: PMC2875926 (ang.).
- ↑ Attention-Deficit/Hyperactivity Disorder and Urinary Metabolites of Organophosphate Pesticides | Articles | Pediatrics, pediatrics.aappublications.org [dostęp 2018-03-03] (ang.).
- ↑ Environmental AirTechs, www.environmentalairtechs.com [dostęp 2017-11-28].
- ↑ Amy R. Marks i inni, Organophosphate pesticide exposure and attention in young Mexican-American children: the CHAMACOS study, „Environmental Health Perspectives”, 118 (12), 2010, s. 1768–1774, DOI: 10.1289/ehp.1002056, PMID: 21126939, PMCID: PMC3002198 (ang.).
- ↑ SA. Rauch i inni, Associations of prenatal exposure to organophosphate pesticide metabolites with gestational age and birth weight, „Environmental Health Perspectives”, 120 (7), 2012, s. 1055-1060, DOI: 10.1289/ehp.1104615, PMID: 22476135, PMCID: PMC3404666.c?
- ↑ Parathion - toxicity, ecological toxicity and regulatory information, pesticideinfo.org [dostęp 2017-11-28].
- ↑ Parathion (Ethyl) - Remaining Use Canceled 9/00, pmep.cce.cornell.edu [dostęp 2017-11-28] (ang.).
- ↑ Diazinon | Diazinon Insecticide, www.greatvistachemicals.com [dostęp 2017-11-28].
- ↑ Slow-Acting - Scientific American, www.scientificamerican.com [dostęp 2017-11-28] (ang.).
- ↑ Welcome to ICIS, www.icis.com [dostęp 2017-11-28] (ang.).
Bibliografia
- Wyatt, P; Warren, S; Organic Synthesis: Strategy and control; John Wiley & Sons, 2007. ISBN 978-0-471-48940-5
Media użyte na tej stronie
chemical structures of illustrative phosphines
(c) V8rik z angielskojęzycznej Wikipedii, CC-BY-SA-3.0
Phosphaalkene General
range of phosphonate structures including sarin
range of phosphate structures including bio









