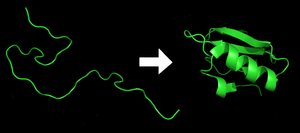
Zwijanie białka
Zwijanie białka, fałdowanie białka – proces fizyczny polegający na formowaniu przez polipeptyd (posiadający strukturę kłębka statystycznego) wysoko zorganizowanej struktury o charakterystycznej i stabilnej konformacji[1].
Przyjmuje się, że każde białko tuż po zakończeniu translacji występuje pod postacią nieustrukturyzowanego łańcucha polipeptydowego. Taki polipeptyd nie wykazuje obecności dobrze zdefiniowanej, stabilnej struktury przestrzennej. Dopiero na skutek interakcji pomiędzy sąsiednimi aminokwasami polipeptyd zaczyna przyjmować określoną konformację, określaną często mianem stanu „natywnego”. Obecnie uważa się, że głównym czynnikiem decydującym o natywnej strukturze danego białka jest jego sekwencja aminokwasowa[2], jednakże niektóre obserwacje wskazują, że naturalna struktura białek występujących w żywej komórce może być zależna od oddziaływań z innymi białkami lub kwasami nukleinowymi.
Należy podkreślić, że dla większości znanych białek prawidłowa struktura przestrzenna jest konieczna dla ich roli fizjologicznej[3]. Niepowodzenie w przyjęciu oczekiwanej struktury zwykle prowadzi do powstania białka o odmiennych właściwościach, które może być nawet toksyczne dla organizmu (przykładem może być wiele białek prionowych). Wiele dowodów wskazuje na to, że pewne choroby neurodegeneracyjne wywołane są akumulacją białek o nieprawidłowej strukturze takich jak amyloidy, formujące długie włókna w komórkach[4].
Przypisy
- ↑ The Shape and Structure of Proteins, [w:] Bruce Alberts i inni, Molecular Biology of the Cell; Fourth Edition, Garland Science, 2002, ISBN 0-8153-3218-1 (ang.).[potrzebny numer strony]
- ↑ Christian Anfinsen, The formation and stabilization of protein structure, „Biochemical Journal”, 128 (4), 1972, s. 737–49, PMID: 4565129, PMCID: PMC1173893 (ang.).
- ↑ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer, Biochemia, Wydawnictwo Naukowe PWN, 2006, ISBN 978-83-01-14379-4.[potrzebny numer strony]
- ↑ Dennis J. Selkoe, Folding proteins in fatal ways, „Nature”, 426, 2003, s. 900–904, DOI: 10.1038/nature02264, PMID: 14685251 (ang.).c?
Media użyte na tej stronie
Illustration of the process of protein folding. Chymotrypsin inhibitor 2 from pdb file 1LW6.