Metody wyznaczania rzędu reakcji chemicznej
Metody wyznaczania rzędu reakcji – metody określania stopnia wielomianu, jakim jest równanie kinetyczne reakcji, czyli zależność jej szybkości od stężenia reagentów. Doświadczalną podstawą określania wartości są wyniki analiz stężenia reagentów, wykonywanych w czasie biegu reakcji. Zgromadzony zbiór wyników analiz chemicznych poddaje się analizie statystycznej, prowadzonej w celu znalezienia takiego wielomianu:
- szybkość ubytku substratu = f (stężenia reagentów),
- np.
który najlepiej opisuje wyniki eksperymentu. Stopień tego wielomianu nazywa się rzędem reakcji, a wykładniki potęg przy stężeniach poszczególnych związków – rzędem względem tych związków. Symbolem oznacza się stałą szybkości reakcji[1][2].
W przypadku reakcji elementarnych rząd reakcji ma wartości = 0, 1 lub 2 (reakcja zerowego rzędu, pierwszorzędowa lub drugorzędowa). Inne wartości – większe od 2 lub ułamkowe – świadczą zwykle o tym, że badana reakcja jest złożona[a]. Wyjaśnienie mechanizmu takich reakcji wymaga stosowania specyficznych metod badawczych, w tym określenia rzędu poszczególnych reakcji elementarnych.
Wśród klasycznych metod wyznaczania rzędu reakcji są wymieniane metody[1][2]:
- podstawienia do wzoru,
- graficzna,
- różnicowa van ’t Hoffa (1884),
- całkowa Ostwalda i Zawidzkiego,
- izolacyjna Ostwalda.
Metoda podstawienia do wzoru
| Czas, | ||||
| ok. 0 | 0,003 | 0,0505 | 0,0762 | 5,6 |
| 5 | 0,0086 | 0,0446 | 0,0703 | 5,8 |
| 10 | 0,0135 | 0,0398 | 0,0655 | 5,8 |
| 20 | 0,023 | 0,0322 | 0,0580 | 5,4 |
| 40 | 0,0311 | 0,0228 | 0,0485 | 5,6 |
| 60 | 0,0355 | 0,0169 | 0,0427 | 5,5 |
Wyniki oznaczeń stężenia reagentów rejestrowane w czasie biegu reakcji, są podstawiane do różnych równań kinetycznych, np. [1][2]:
Oblicza się wartości i sprawdza, które z równań prowadzi do wyników niezmiennych (zmienność w granicach błędu pomiarów), czyli do rzeczywistej wartości stałej szybkości reakcji
Sprawdzając np. czy dla reakcji A + B wykładnik oblicza się wartości z zależności:
gdzie: i – początkowe stężenia reagentów, i – stężenia chwilowe.
Potwierdzeniem założenia jest uzyskanie wartości które nie zależą od i
Metoda graficzna
Istota metody, tradycyjnie nazywanej graficzną, nie różni się od „metody podstawienia do wzoru”. W obu przypadkach sprawdza się, które z równań kinetycznych najlepiej odpowiada danym doświadczalnym. W przeszłości wyniki wykonywanych analiz, np. kolejnych oznaczeń stężenia substratu ręcznie nanoszono na wykresy, sporządzane w tak dobranym układzie współrzędnych, aby wykazanie zależności prostoliniowej świadczyło o określonym rzędzie reakcji[b]. Linie proste uzyskuje się w układzie współrzędnych[1][2]:
- – gdy reakcja jest zerowego rzędu,
- – gdy reakcja jest pierwszego rzędu,
- – gdy reakcja jest drugiego rzędu,
- – gdy reakcja jest trzeciego rzędu.
Jeżeli w każdym z wymienionych układów współrzędnych stwierdza się odchylenia od linii prostej, przyjmuje się, że reakcja ma rząd ułamkowy, charakterystyczny dla reakcji złożonych[1][2].
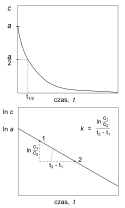
Krzywe kinetyczne reakcji pierwszego rzędu[1][2]
– stężenie substratu, – stężenie początkowe, – stała szybkości reakcji, – czas połowicznej przemianyKrzywe kinetyczne reakcji drugiego rzędu[1][2]
– stężenie substratu, – stężenie początkowe, – czas połowicznej przemiany
Metoda różnicowa van ’t Hoffa
| t [min] | a1 [mmol/l] | Δa1/dt | log a1 | log Δa1/Δt |
| 0 | 8,88 | |||
| 95 | 7,87 | 0,0108 | -1,9666 | |
| śr. 8,37 | 0,9227 | |||
| t [min] | a2 [mmol/l] | Δa2/Δt | log a2 | log Δa2/Δt |
| 0 | 3,81 | |||
| 132 | 3,51 | 0,00227 | -2,6440 | |
| śr. 3,66 | 0,5635 |
„Metoda różnicowa” została opracowana przez van ’t Hoffa w 1884 roku. Doświadczalną podstawą obliczeń rzędu reakcji jest w tym przypadku zależność szybkości reakcji w jej początkowym okresie od początkowego stężenia substratu A
Przyjmuje się, że ogólne równanie kinetyczne[1][2]:
w okresie początkowym można zastąpić przez:
Dla dwóch reakcji, prowadzonych przy różnych stężeniach początkowych, otrzymuje się:
Wynikiem podzielenia równań stronami i zlogarytmowania jest zależność:
lub, po przejściu na skończone wartości przyrostów ( i ):
Metoda całkowa Ostwalda i Zawidzkiego
Podstawą całkowej metody Ostwalda i Zawidzkiego są również wyniki analiz, zgromadzone w dwóch eksperymentach, wykonanych z zastosowaniem różnych wartości początkowego stężenia substratu. W odróżnieniu od metody różnicowej reakcji nie kończy się w okresie początkowym, ale prowadzi do osiągnięcia jednakowego w obu przypadkach stopnia przereagowania (np. zmniejszenie stężenia razy)[1][2].
Założenia metody ilustrują następujące przekształcenia ogólnego równania kinetycznego (dla reakcji o jednakowych stężeniach substratów):
- po zgrupowaniu zmiennych:
- po scałkowaniu w granicach od do :
W przypadku dwóch reakcji, rozpoczynanych od stężeń początkowych i i kończonych na stężeniach i otrzymuje się, po uproszczeniach, równania:
Podzielenie obu otrzymanych równań stronami oraz zlogarytmowanie i kolejne przekształcenia prowadzą do zależności umożliwiającej obliczanie rzędu reakcji na podstawie zmierzonych wartości i
Metoda izolacyjna Ostwalda
Metodą izolacyjną jest nazywane postępowanie, które umożliwia wyznaczanie rzędu reakcji względem pojedynczych reagentów, np. względem A i B w reakcji A + B → produkty, dla której równanie kinetyczne ma postać:
Prowadzenie reakcji przy dużym nadmiarze substratu A umożliwia wyznaczenie rzędu względem substratu B (stężenia A jest uznawane za stałe). Analogicznie wyznacza się rząd względem A, stosując duży nadmiar substratu B. Sumaryczny rząd reakcji jest sumą rzędów względnych[1][2].
Uwagi
- ↑ Według teorii zderzeń reakcje chemiczne zachodzą w wyniku zderzeń cząsteczek o wystarczająco dużej energii, a szybkość reakcji jest proporcjonalna do liczby takich zderzeń, związanej ze stężeniem reagentów. Zajście reakcji, które wymagają zderzenia trzech cząsteczek i mogłyby być elementarnymi reakcjami trzeciego rzędu, jest bardzo mało prawdopodobne.
- ↑ Współcześnie obliczenia i ich graficzna ilustracja są wykonywane równocześnie, z użyciem tych samych, prostych programów komputerowych.
![Krzywe kinetyczne reakcji pierwszego rzędu[1][2] '"`UNIQ--postMath-00000029-QINU`"' – stężenie substratu, '"`UNIQ--postMath-0000002A-QINU`"' – stężenie początkowe, '"`UNIQ--postMath-0000002B-QINU`"' – stała szybkości reakcji, '"`UNIQ--postMath-0000002C-QINU`"' – czas połowicznej przemiany](http://upload.wikimedia.org/wikipedia/commons/thumb/9/91/Reakcja_I_rz.svg/241px-Reakcja_I_rz.svg.png)
![Krzywe kinetyczne reakcji drugiego rzędu[1][2] '"`UNIQ--postMath-0000002D-QINU`"' – stężenie substratu, '"`UNIQ--postMath-0000002E-QINU`"' – stężenie początkowe, '"`UNIQ--postMath-0000002F-QINU`"' – czas połowicznej przemiany](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ea/Reakcja_II_rz.svg/226px-Reakcja_II_rz.svg.png)