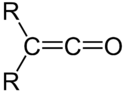
Keteny
Keteny – nienasycone ketony ze skumulowanymi podwójnymi wiązaniami >C=C=O. Przeważnie gazowe, bardzo reaktywne i toksyczne związki chemiczne. Chemię ketenów jako pierwszy badał Hermann Staudinger[1].
Zwyczajowo ketenem nazywa się najprostszego przedstawiciela tej grupy związków, etenon (CH
2=C=O).
Keten (etenon) – właściwości
Etenon jest bezbarwnym gazem o ostrym zapachu, drażniącym oczy i błony śluzowe, po dłuższej ekspozycji może wystąpić obrzęk płuc. Temp. topn. −150 °C, temp. wrz. −49 °C[2].
Etenon ma 8 teoretycznie możliwych izomerów (4 tautomery, 2 izomery typu eteru i 2 izomery cykliczne typu oksiranu), z których teoretycznie najtrwalszy i potencjalnie najłatwiejszy do zaobserwowania jest hydroksyacetylen, CH≡C−OH:
Ma on energię o 152 kJ/mol większej od ketenu, ale jest oddzielony od niego barierą energetyczną o wysokości 305 kcal/mol[3], dzięki czemu ma on charakter związku metastabilnego. Można go wygenerować w spektrometrze mas[4].
Otrzymywanie
- z chlorków kwasowych przez eliminację chlorowodoru za pomocą zasady, zazwyczaj trietyloaminy:
- przegrupowanie Wolffa α-diazoketonów (przebiegające poprzez oksiren przegrupowujący się następnie do ketenu[3])
- dehydratacja kwasu fenylooctowego za pomocą zasady (wykorzystuje się tu dużą kwasowość protonu α substratu).
Reaktywność
Keteny są bardzo reaktywnymi związkami acylującymi. Hydrolizują do kwasów karboksylowych, pod wpływem amoniaku tworzą amidy, natomiast w reakcji z alkoholami dają estry. Z bogatymi w elektrony alkinami ulega cykloaddycji [2+2] do cyklobutenonów.
Łatwo dimeryzują do cyklicznych diketenów[2]:
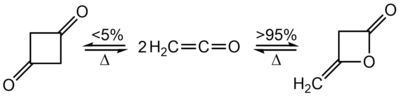
Reakcja ta przebiega w ponad 95% w kierunku β-laktonu, czemu towarzyszy powstawanie małych ilości cyklobutano-1,3-dionu. Po ogrzaniu diketenu do 350–600 °C następuje odtworzenie ketenu, co jest wykorzystywane jako wygodne źródło tego związku w skali laboratoryjnej[2].
Bis-keteny (O=C=CH−R′−CH=C=O) polimeryzują z diolami (HO−R−OH) dając poliestry o wzorze ogólnym (−O−R−O−CO−CH
2−R′−CH
2−CO−)
n.
Przypisy
- ↑ Hermann Staudinger, Ketene, eine neue Körperklasse, „Berichte der deutschen chemischen Gesellschaft”, 38 (2), 1905, s. 1735–1739, DOI: 10.1002/cber.19050380283 (niem.).
- ↑ a b c d Raimund Miller i inni, Ketenes, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, s. 6–7, DOI: 10.1002/14356007.a15_063 (ang.).
- ↑ a b Willem J. Bouma i inni, Existence of stable structural isomers of ketene. A theoretical study of the C2H2O potential energy surface, „Journal of Organic Chemistry”, 47 (10), 1982, s. 1869–1875, DOI: 10.1021/jo00349a010 (ang.).
- ↑ Ben van Baar i inni, Hydroxyacetylene: Generation and Characterization of the Neutral Molecule, Radical Cation and Dication in the Gas Phase, „Angewandte Chemie International Edition in English”, 25 (3), 1986, s. 282–284, DOI: 10.1002/anie.198602821 (ang.).
Media użyte na tej stronie
General structure of ketenes
Tautomerism of ethynol and ketene
Dimeryzacja ketenu
Ethenone