Tellur
| antymon ← tellur → jod | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| srebrzystoszary | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Widmo emisyjne telluru | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nazwa, symbol, l.a. | tellur, Te, 52 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupa, okres, blok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stopień utlenienia | −II, −I, IV, VI[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości metaliczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości tlenków | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atomowa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stan skupienia | stały | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gęstość | 6240 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura topnienia | 449,51 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura wrzenia | 988 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą warunków normalnych (0 °C, 1013,25 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tellur (Te, łac. tellurium) – pierwiastek chemiczny, tlenowiec z grupy półmetali w układzie okresowym. Nazwa pochodzi od łacińskiej nazwy Ziemi – tellus.
Charakterystyka
Tellur w postaci krystalicznej jest srebrzystobiały, miękki i kruchy[5] (handlowo dostępny jest w postaci szarego proszku[6]). Jest półprzewodnikiem[5]. Reaguje ze stężonym kwasem azotowym, tworząc kwas tellurawy (H
2TeO
3), w reakcji telluru z wodą królewską powstaje kwas tellurowy (H
2TeO
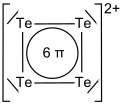
4). Ze stężonym gorącym kwasem siarkowym tellur reaguje, tworząc roztwór o barwie czerwonej, zawierający kationy tetratellurowe Te2+
4. Zabarwienie wynika z obecności 6 zdelokalizowanych elektronów π w płaskiej, kwadratowej strukturze kationów tetratellurowych. Kationy te pod wpływem wody hydrolizują z wydzieleniem czarnego osadu telluru.
Tworzy tellurki M
2Te, telluryny M
2TeO
3 i tellurany M
2TeO
4 (gdzie M – kation metalu jednowartościowego). Tellurowodór H
2Te jest nietrwałym, trującym gazem, o nieprzyjemnym zapachu. Pył i pary telluru działają szkodliwie przy ich wdychaniu, drażnią także oczy.
Występowanie
W skorupie ziemskiej występuje on w ilości 0,005 ppm. Minerałem tego pierwiastka jest np. telluryt (TeO
2).
Odkrycie
Związki zawierające tellur zostały odkryte w 1782 w kopalni złota w dawnej Kleinschlatten (Transylwania), a obecnie w Zlatnej (Rumunia) przez austriackiego mineraloga Franza-Josepha Müllera von Reichensteina[7][8], nazwany przez Martina Heinricha Klaprotha[7] w 1798.
Zastosowanie
Tellur używany jest przede wszystkim jako składnik stopów z żelazem, miedzią i ołowiem. Dodatek telluru powoduje, że stop jest łatwiejszy do obróbki. Jest również używany do produkcji półprzewodników, a także w procesie wulkanizacji[9] gumy i jako przeciwstukowy składnik benzyn[9]. Tellurek kadmu używany do produkcji paneli fotowoltaicznych[10], a niektóre związki wykorzystywane są do środków owadobójczych[9].
Uwagi
- ↑ Znane są próbki geologiczne, w których pierwiastek ten ma skład izotopowy odbiegający od występującego w większości źródeł naturalnych. Masa atomowa pierwiastka w tych próbkach może więc różnić się od podanej w stopniu większym niż wskazana niepewność.
Przypisy
- ↑ a b David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 4-36, ISBN 978-1-4200-9084-0 (ang.).
- ↑ Tellurium (nr 264865) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Stanów Zjednoczonych. [dostęp 2011-10-02]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ N.N. Greenwood, A. Earnshaw: Chemistry of the elements. Oxford; New York: Pergamon Press, 1984, s. 893. ISBN 0-08-022057-6.
- ↑ Thomas Prohaska i inni, Standard atomic weights of the elements 2021 (IUPAC Technical Report), „Pure and Applied Chemistry”, 94 (5), 2021, s. 573–600, DOI: 10.1515/pac-2019-0603 (ang.).
- ↑ a b tellur, [w:] Encyklopedia techniki. Chemia, Władysław Gajewski (red.), Warszawa: Wydawnictwa Naukowo-Techniczne, 1965, s. 701, OCLC 33835352.
- ↑ Tellurium (nr 264865) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2011-10-02]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b tellur, [w:] Encyklopedia PWN [online] [dostęp 2021-03-04].
- ↑ Ignacy Eichstaedt: Księga pierwiastków. Warszawa: Wiedza Powszechna, 1973, s. 317. OCLC 839118859.
- ↑ a b c Tellur i polon – Principles of Chemistry, www.malecki.chemia.us.edu.pl [dostęp 2021-03-04].
- ↑ M. Sibiński, Polycrystalline solar cells based on CdTe, „Zeszyty Naukowe. Elektryka / Politechnika Łódzka”, z. 115, 2008, s. 111–116, ISSN 0374-4817 [dostęp 2021-03-04] (ang.).
Bibliografia
- Jerzy Minczewski, Zygmunt Marczenko: Chemia analityczna. T. 1: Podstawy teoretyczne i analiza jakościowa. Warszawa: Wydawnictwo Naukowe PWN, 2001. ISBN 83-01-13499-2.
Media użyte na tej stronie
Autor: Original PNGs by Daniel Mayer, traced in Inkscape by User:Stannered, Licencja: CC-BY-SA-3.0
Hexagonal crystal structure
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Autor: Dschwen, Licencja: CC BY 2.5
Ultra pure tellurium crystal. Length ca. 2cm. Image taken by User:Dschwen on January 5th 2006.
Tetratellurium dication Te42+
Autor: McZusatz (talk), Licencja: CC0
Tellurium spectrum; 400 nm - 700 nm