Medyczne zastosowanie trójtlenku arsenu
| Trójtlenek arsenu | |
|---|---|
| ATC | L01XX27 |
| stosowanie w ciąży | kategoria D |
| okres półtrwania | 92 godziny[1] |
| wiązanie z białkami osocza | nieistotne |
| metabolizm | metylacja[1] |
| wydalanie | z moczem (60% w ciągu 8 dni)[1] |
| drogi podawania | dożylnie[1] |
Medyczne zastosowanie trójtlenku arsenu – wykorzystanie trójtlenku arsenu (łac. Arsenum trioxydatum[2], tzw. „arsenu” lub „arszeniku”) jako leku przeciwnowotworowego w leczeniu ostrej białaczki promielocytowej. Trójtlenek arsenu ma status leku sierocego[3]; dostępny jest jako preparat farmaceutyczny Trisenox. W kontakcie z wodą tworzy kwas arsenawy, który jest prawdopodobnie właściwą substancją aktywną biologicznie.
Działanie tej substancji polega na hamowaniu proliferacji komórek nowotworowych oraz doprowadzeniu do ich różnicowania lub apoptozy, ale mechanizm działania leku nie jest do końca poznany. Arszenik, ze względu na swoje toksyczne właściwości, od wieków stosowany był jako skuteczna, a przy tym praktycznie niewykrywalna dla zmysłów[4] trucizna[5]. W XX wieku zauważono jego przeciwnowotworowe działanie, jednak próby doustnego podawania zakończyły się niepowodzeniem. Dopiero próby z dożylnym preparatem tej substancji dały pozytywny wynik, szczególnie w leczeniu rzadkiej odmiany nowotworu złośliwego – ostrej białaczki promielocytowej. Terapię tym lekiem wprowadza się po niepowodzeniu leczenia retinoidem i chemioterapią. Leczenie to charakteryzuje się względnym bezpieczeństwem i niewielkimi działaniami ubocznymi[6]. Prowadzone są badania nad znalezieniem innych zastosowań leku.
Historia
W XVIII wieku William Withering stwierdził, że trójtlenek arsenu stosowany w małych dawkach wykazuje działanie lecznicze[7]. W tym samym wieku Thomas Fowler sporządził 1% roztwór arszeniku i węglanu potasu, który stosowany był w leczeniu chorób skóry (przede wszystkim łuszczycy) aż do XX wieku[8]. Powstał również lek oparty na bazie arsenu – salwarsan – stosowany w leczeniu kiły, zsyntetyzowany przez Paula Ehrlicha. Został on jednak wyparty przez penicylinę[9]. Związki arsenu były powszechnie wykorzystywane w leczeniu różnych chorób w XIX i na początku XX wieku[8][10][11].
Pierwsze doniesienia o aktywności przeciwnowotworowej trójtlenku arsenu pochodzą z 1878 roku, kiedy to w raporcie Boston City Hospital opisano działanie roztworu Fowlera obniżające poziom leukocytów we krwi u dwóch zdrowych osób i jednego chorego[5][12]. Trójtlenek arsenu był stosowany w leczeniu białaczki aż do momentu wprowadzenia radioterapii. Powrócił do łask w latach 30. XX wieku, kiedy to pojawiły się pierwsze badania potwierdzające wysoką skuteczność trójtlenku arsenu w leczeniu przewlekłej białaczki szpikowej[13].
Pod koniec lat 60. XX w. lekarzy pracujących w Akademii Medycznej w Harbin w Chinach wysłano do ośrodka zajmującego się tradycyjną medycyną chińską. Stosowano tam maść na czerniaka, której głównym składnikiem był arszenik. W tamtych czasach arsenał leków przeciwnowotworowych był bardzo ograniczony, wobec czego lekarze zaczęli stosować arszenik. Pierwsze próby opierały się na doustnym podawaniu tej substancji, wykazywała ona jednak silne działanie toksyczne. W marcu 1971 rozpoczęto pierwsze próby, w których arszenik podawano dożylnie. W takiej postaci wykazywał znacznie mniejszą toksyczność. Przez wiele lat tlenek arsenu(III) podawano chorym z różnymi nowotworami, najlepsze efekty uzyskując w leczeniu ostrej białaczki promielocytowej[14]. Spośród pacjentów uczestniczących w pierwszej serii prób w Harbin więcej niż połowa przeżyła 5 lat. Dzięki temu badania rozszerzono na inne ośrodki w Chinach[15][16], a następnie zorganizowano je w Sloan-Kettering Memorial Institute w Nowym Jorku[17]. Wyniki badań klinicznych okazały się na tyle korzystne, że w 2000 roku lek uzyskał aprobatę FDA[18].
Mechanizm działania






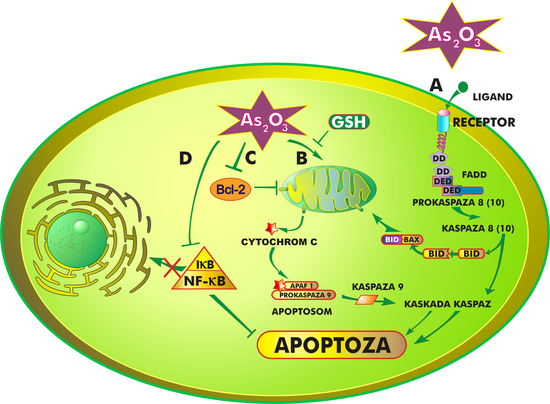
Mechanizm działania trójtlenku arsenu jest złożony i nie do końca poznany. Ogólnie rzecz ujmując, lek hamuje proliferację komórek nowotworowych oraz doprowadza do ich różnicowania i/lub apoptozy, która przebiegać może w różny sposób, w zależności od zaangażowanych w nią organelli komórkowych i procesów biochemicznych. Trójtlenek arsenu indukuje apoptozę na drodze:
- oddziaływania z receptorami błony komórkowej (ścieżka zewnętrzna)
- oddziaływania z mitochondriami (ścieżka wewnętrzna)
Pierwsza z tych dróg polega na połączeniu ligandu z receptorem znajdującym się na powierzchni błony komórkowej. Zespolenie tych dwóch cząstek prowadzi do aktywacji wielu różnych genów oraz uwalnia kaskadę białek, charakterystycznych dla procesu apoptozy[26].
Trójtlenek arsenu oddziałuje również na mitochondria. Jedną z pierwszych zmian w ich strukturze, wywołaną działaniem leku, jest otwarcie megakanałów i wypływ tzw. białek śmierci, przede wszystkim cytochromu C, APAF-1 (czynnik aktywacji proteaz apoptotycznych, ang. apoptotic peptidase activating factor 1), czynnika AIF, białka Smac/DIABLO i endonukleazy z przestrzeni międzybłonowej mitochondriów do cytozolu. W cytoplazmie powstaje kompleks białek zwany apoptosomem, który uruchamia dalsze procesy prowadzące do apoptozy[27].
Bez względu na to, czy apoptoza indukowana jest zewnętrznie czy wewnętrznie, zawsze biorą w niej udział kaspazy, których aktywacja nieodwracalnie prowadzi komórkę na drogę programowanej śmierci[28][29]. Ponadto apoptoza regulowana jest przez białka z rodziny Bcl-2, które działać mogą zarówno pro-, jak i antyapoptotycznie[30].
Przyczyną występowania ostrej białaczki promielocytarnej jest translokacja genu kodującego receptor kwasu retinowego (RAR α) z chromosomu 17 w pobliże genu PML, znajdującego się na chromosomie 15. Prowadzi to do fuzji genów i powstania produktu PML/RAR α[31]. Białko to hamuje różnicowanie oraz śmierć komórek, w których się znajduje. Trójtlenek arsenu, już w małych stężeniach, powoduje rozpad PML/RAR α, przywracając w ten sposób (częściowo) różnicowanie zmienionych nowotworowo promielocytów[32]. Trójtlenek arsenu aktywuje kinazę JNK, zwaną również kinazą N-końca białka c-jun (ang. c-jun N-terminal kinase) lub kinazą aktywowaną stresem (ang. stress-activated protein kinase – SAPK), należącą do rodziny kinaz MAPK (ang. mitogen-activated protein kinases). Enzymy te mają kluczowe znaczenie dla przekazywania sygnałów w komórce. W normalnych warunkach kinaza JNK aktywowana jest przez fosforylację reszt treoniny i tyrozyny[33][34]. W badaniach na określonych liniach komórkowych pobranych od chorych z ostrą białaczką promielocytową udowodniono jednak, że wspomniana aktywacja zachodzi również pod wpływem trójtlenku arsenu[35].
Wydaje się, że aktywacja kinazy JNK prowadzi do fosforylacji zarówno białek antyapoptotycznych (Bcl-2, Bcl-Xl), jak i białek proapoptotycznych – Bax (ang. Bcl-2-associated X protein), Bak (ang. Bcl-2 homologous killer) i Bid (ang. BH3 interacting domain death agonist), czyli de facto do ich uczynnienia. Białka proapoptotyczne zawierają domenę BH3, która odpowiada za ich "śmiercionośną" aktywność. Powodują one powstawanie kanałów jonowych w błonie mitochondrium, czego wynikiem jest wypływ wspomnianych już czynników apoptotycznych do cytoplazmy. Białka antyapoptotyczne zawdzięczają swoje działanie hydrofobowej szczelinie w ich strukturze przestrzennej, która wiąże się z domeną BH3, neutralizując tym samym działanie "śmiercionośnych" białek. W normalnych warunkach o apoptozie komórki decyduje stosunek ilości białek proapoptotycznych do antyapoptotycznych. W przypadku apoptozy indukowanej trójtlenkiem arsenu dużą rolę odgrywają dwa mechanizmy, które powodują zwiększenie ilości białek proapoptotycznych. Pierwszy z nich związany jest z funkcjonowaniem czynnika transkrypcyjnego NF-κB (ang. nuclear factor kappa-light-chain-enhancer of activated B cells). Występuje on w cytoplazmie w stanie nieaktywnym, w kompleksie ze specyficznym inhibitorem IκB (IKK). Składa się on z dwóch podjednostek katalitycznych – IKKα i IKKβ oraz z jednostki regulatorowej IKKγ/NEMO. Fosforylacja inhibitora i jego rozpad uwalnia NF-κB, który wędruje do jądra komórkowego i aktywuje geny odpowiedzialne za produkcję białek "życia" (p53, Bcl-2 i inne inhibitory apoptozy). NF-κB chroni również komórki przed apoptotyczną stymulacją z udziałem receptora TNF-α. Trójtlenek arsenu łączy się z cysteiną znajdującą się w pozycji 179 IKKβ, uniemożliwiając tym samym uwolnienie NF-κB[36]. Brak tego białka w cytoplazmie umożliwia indukcję apoptozy drogą zewnętrzną oraz aktywuje kaspazy 3 i 8[37].
Mechanizm taki zaobserwowano nie tylko w komórkach ostrej białaczki promielocytowej i ziarnicy złośliwej, ale również u pacjentów z zespołem mielodysplastycznym[36][38][39]. Drugim mechanizmem zwiększającym ilość białek proapoptotycznych jest obniżenie transkrypcji genu bcl-2[40]. Działanie to zaobserwowano w komórkach HL-60 i NB4 białaczek ludzkich[41][42].
W 2003 roku naukowcy japońscy odkryli, że trójtlenek arsenu indukuje apoptozę nie tylko przy pomocy receptora TNF-α. Badania wskazują na to, że lek działa proapoptotycznie również poprzez receptor CD95, który wpływa na aktywację kaspaz 8 i 3[43][44]. W komórkach szpiczaka trójtlenek arsenu oddziałuje z receptorem APO2/TRAIL, aktywując kaspazy 8 i 9[45][46].
Trójtlenek arsenu wpływa również na wewnątrzkomórkowe stężenie glutationu, który jest bardzo ważnym elementem układu oksyredukcyjnego (m.in. usuwa wolne rodniki, redukuje nadtlenek wodoru). Bierze on również udział, razem z peroksydazą i katalazą[47], w regulacji poziomu reaktywnych form tlenu. Trójtlenek arsenu hamuje peroksydazę glutationu, zmniejszając tym samym jego stężenie w komórce, co prowadzi do wzrostu poziomu wolnych rodników tlenowych[48]. Te z kolei zwiększają przepuszczalność błony mitochondrium, powodując wypływ białek śmierci i rozpoczęcie procesu apoptozy[49].
Trójtlenek arsenu wpływa również degradująco na polimerazę poli(ADP-rybozy), co w połączeniu z aktywacją kaspaz hamuje naprawę DNA i zatrzymuje cykl komórkowy[50]. To, w jakiej fazie cykl komórkowy zostanie zablokowany, zależy w głównej mierze od białka p53. W komórkach zawierających tzw. typ dziki (niezmutowany) p53 cykl ulega zahamowaniu w interfazie, natomiast w komórkach ze zmutowanym p53 – w fazie G2/M[45][51].
Badania kliniczne
Trójtlenek arsenu był badany klinicznie w dwóch otwartych, jednoramiennych badaniach bez grupy kontrolnej, na 52 pacjentach z ostrą białaczką promielocytową, u których wcześniej bez powodzenia stosowano antracykliny i retinoidy. Wyniki tych badań przedstawia poniższa tabela.
| Badanie jednoośrodkowe n=12 | Badanie wieloośrodkowe n=40 | ||
|---|---|---|---|
| Dawka trójtlenku arsenu (w mg/kg mc./dobę) | 0,16 (mediana: 0,06-0,20) | 0,15 | |
| Całkowita remisja | 11 osób (92%) | 34 osoby (85%) | |
| Średni czas do remisji szpiku kostnego | 32 dni | 35 dni | |
| Średni czas do uzyskania całkowitej remisji | 54 dni | 59 dni | |
| 18-miesięczny okres przeżycia | 67% | 66% | |
| n – liczba pacjentów biorących udział w badaniu | |||
Prowadzono również badania nad działaniem trójtlenku arsenu na inne nowotwory. Wykazały one, że lek działa apoptotycznie również na komórki raka płuc (szczególnie w połączeniu z sulindakiem[56]). Udowodniono również skuteczność trójtlenku arsenu w terapii szpiczaka mnogiego, w połączeniu z kwasem askorbinowym[57] i bortezomibem[58].
Doświadczenia na zwierzętach wykazały, że lek działa również na nowotwory jajnika[59], wątroby, żołądka[60], prostaty, piersi[61] oraz w glejaku[62] i raku trzustki (w połączeniu z partenolidem)[63]. Próby wykorzystania trójtlenku arsenu w leczeniu nowotworów litych zostały ograniczone przez toksyczność leku[64].
Tlenek arsenu wydaje się być obiecującym środkiem w leczeniu chorób autoimmunologicznych (w oparciu o badanie na myszach)[65].
Farmakokinetyka
Nie prowadzono szczegółowych badań odnośnie do farmakokinetyki trójtlenku arsenu. Przy podawaniu dożylnym stan równowagi ustala się po 8–10 dniach. Arsen wiąże się z białkami w nieistotnym stopniu. Największe stężenie arsenu wykrywane jest w wątrobie, nerkach, sercu, płucach, włosach i paznokciach. Kwas arsenawy jest utleniany do kwasu arsenowego oraz metylowany w wątrobie[66][67][68], a następnie wydalany w 60% z moczem. Okres półtrwania wynosi 92 godziny. Lek nie jest substratem ani inhibitorem izoenzymów cytochromu P450 (1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1,3A4/5, 4A9/11)[69][70].
Wskazania
Trójtlenek arsenu przeznaczony jest do indukcji remisji i konsolidacji ostrej białaczki promielocytowej (APL, ang. Acute Pro-Myelotic Leucaemia) u dorosłych pacjentów, u których występuje translokacja t(15; 17) i/lub obecność genu PML/RAR α. Lek powinien być stosowany po niepowodzeniu leczenia lub w nawrocie choroby. Wcześniejsza terapia powinna obejmować podawanie retinoidu i chemioterapii[71].
Przeciwwskazania
- Nadwrażliwość na trójtlenek arsenu lub jakikolwiek inny składnik preparatu.
- Ciąża i karmienie piersią są przeciwwskazaniami względnymi (lek przechodzi do mleka matki). Chociaż nie prowadzono badań na kobietach w ciąży, to w badaniach na zwierzętach wykazano teratogenne i embriotoksyczne działanie trójtlenku arsenu. Nie wykazano działania rakotwórczego trójtlenku arsenu, jednakże podobnie jak inne nieorganiczne związki arsenu, jest uznawany za czynnik rakotwórczy.
Ostrzeżenia specjalne
W celu bezpiecznego stosowania leku należy stosować się do poniższych zaleceń[72]:
- U 25% pacjentów leczonych trójtlenkiem arsenu występowały objawy podobne do zespołu aktywacji leukocytów. Charakteryzuje się on wysoką gorączką, dusznościami, przyrostem masy ciała, naciekami płucnymi z obecnością płynu wysiękowego w opłucnej lub osierdziu z leukocytozą lub bez. Stosowanie dużych dawek steroidów (10 mg deksametazonu dożylnie 2–3 razy na dobę) wydaje się łagodzić objawy[73].
- U 40% pacjentów leczonych trójtlenkiem arsenu wystąpił co najmniej raz wydłużony, skorygowany odstęp QT powyżej 500 ms[74]. Wydłużenie odstępu QT może powodować wystąpienie arytmii komorowej typu torsade de pointes[75].
- Przed rozpoczęciem leczenia trójtlenkiem arsenu należy wykonać badanie EKG oraz oznaczyć stężenie potasu, wapnia, magnezu i kreatyniny we krwi. Wszelkie nieprawidłowości powinny zostać skorygowane przed podaniem trójtlenku arsenu, a w szczególności nieprawidłowości w zapisie EKG pod postacią wydłużonego odstępu QT. Jeśli to możliwe, należy przerwać podawanie leków wpływających na wydłużenie odstępu QT[76].
- Pacjenci leczeni trójtlenkiem arsenu, szczególnie ci narażeni na wystąpienie torsade de pointes, powinni być monitorowani podczas podawania leku[77][78].
- Leczenie preparatem należy zmodyfikować lub przerwać przed planowanym zakończeniem leczenia w przypadku, gdy stopień toksyczności osiągnie wartość 3 (według National Cancer Institute). Pacjenci mogą podjąć leczenie z powrotem dopiero po ustąpieniu objawów związanych z toksycznością trójtlenku arsenu. W takich przypadkach należy wznowić leczenie podając 50% wcześniejszej dawki dobowej. Dawkę można zwiększyć do poziomu wcześniejszej dawki dopiero wtedy, gdy w ciągu 3 dni nie wystąpią objawy toksyczności. Pacjenci, u których pojawiły się one po raz drugi, nie mogą kontynuować leczenia trójtlenkiem arsenu.
- U pacjentów w fazie indukcji remisji (patrz: Dawkowanie) należy 2 razy w tygodniu badać stężenie elektrolitów i glukozy we krwi, morfologię oraz czynność wątroby i nerek. Podczas fazy konsolidacyjnej badania te należy wykonywać raz w tygodniu.
- Należy zachować szczególną ostrożność w przypadku pacjentów cierpiących na niewydolność nerek[79].
- Podczas leczenia trójtlenkiem arsenu kobiety w wieku rozrodczym i mężczyźni zdolni do zapłodnienia powinni stosować skuteczne metody antykoncepcji. Nie zbadano dokładnie wpływu trójtlenku arsenu na płodność.
Interakcje
Wiadomo, że trójtlenek arsenu wydłuża odstęp QT. O ile to możliwe, podczas stosowania preparatu nie należy stosować leków wydłużających QT, takich jak[80][81]:
- leki przeciwarytmiczne klasy Ia i III (chinidyna, amiodaron, sotalol, dofetylid)
- niektóre leki stosowane w leczeniu zaburzeń psychicznych (np. amitryptylina, tiorydazyna)
- niektóre makrolidy (np. erytromycyna)
- niektóre leki przeciwhistaminowe (np. terfenadyna, astemizol)
- niektóre chinolony (np. sparfloksacyna)
- inne leki wydłużające odstęp QT (np. cyzapryd)
Stwierdzono również, że wcześniejsze stosowanie:
- antracyklin
- amfoterycyny B
- diuretyków nieoszczędzających potasu
- innych leków powodujących hipokalemię lub hipokalcemię
zwiększa prawdopodobieństwo wystąpienia torsade de pointes.
Działania niepożądane[82]
Działania niepożądane stwierdzono u 37% pacjentów leczonych trójtlenkiem arsenu. Nie miały one jednak dużego nasilenia i mijały w trakcie leczenia. Należy zaznaczyć, że pacjenci znacznie lepiej znoszą leczenie konsolidacyjne niż indukujące remisję. Do najczęściej występujących objawów niepożądanych zaliczyć można:
- hiperglikemię
- hipokalemię
- neutropenię
- zwiększenie aktywności AlAt
- leukocytozę[83][84]
Bardzo nasilone objawy uboczne są dość rzadkie i obejmują:
- zespół aktywowanych leukocytów
- wydłużenie odstępu QT (podczas badań klinicznych odnotowano tylko jeden przypadek torsade de pointes)
- migotanie lub trzepotanie przedsionków
Pozostałe działania niepożądane obejmują skórne reakcje alergiczne (w tym reakcje w miejscu podania, ból w miejscu podania[66]), zaburzenia przewodu pokarmowego (biegunki), bóle różnego rodzaju, zaburzenia widzenia[85], krwawienia[86]. W razie wynaczynienia leku może wystąpić miejscowe podrażnienie i zapalenie żył[66].
Dawkowanie
Schemat stosowania trójtlenku arsenu obejmuje leczenie indukujące remisję, po którym następuje terapia konsolidująca.
W celu indukcji remisji trójtlenek arsenu powinien być podawany we wlewie dożylnym w dawce 0,15 mg/kg mc./dobę codziennie (jednakowo u dzieci, dorosłych i u starszych osób), do momentu uzyskania poprawy w obrazie szpiku kostnego. Leczenie indukujące nie powinno być dłuższe niż 50 dni. W razie braku remisji stwierdzonej w badaniu szpiku kostnego do 50. dnia terapii, należy przerwać leczenie. Leczenie konsolidacyjne (mające na celu eliminację resztkowych komórek nowotworowych) należy rozpocząć w 3–4 tygodniu po zakończeniu leczenia indukującego. Lek podaje się dożylnie w dawce 0,15 mg/kg mc./dobę, 5 dni w tygodniu przez 5 tygodni.
Trójtlenek arsenu powinno podawać się we wlewie trwającym 1–2 godziny. W przypadku wystąpienia reakcji naczynioruchowych czas podawania można wydłużyć do 4 godzin[1].
Przedawkowanie
W przypadku wystąpienia objawów zatrucia arsenem (drgawki, osłabienie mięśniowe, splątanie[87]) należy natychmiast zaprzestać podawania leku oraz wdrożyć odpowiednie leczenie. Najczęściej stosuje się penicylaminę w dawce do 1 g/dobę[88]. U pacjentów, którzy nie mogą przyjmować leków doustnie, można podawać dimerkaprol domięśniowo w dawce 3 mg/kg mc. co 4 godziny[89], aż do ustąpienia objawów zagrażających życiu. W przypadku wystąpienia koagulopatii[90] zaleca się podawanie DMSA w dawce 10 mg/kg mc. co 8 godzin przez 5 dni, a następnie co 12 godzin przez 2 tygodnie[91]. Można również rozważyć zastosowanie dializy[92].
Preparaty i postać leku
- Trisenox – Almac Pharma – 1 mg/ml, koncentrat do sporządzania roztworu do infuzji.
- Trisenox jest pakowany w ampułki o pojemności 10 ml, przeznaczone do jednokrotnego użytku[93]. Ampułki zawierają czysty roztwór trójtlenku arsenu, bez konserwantów, a także wodorotlenek sodu i kwas solny[93]. pH roztworu wynosi 7–9[93]. Lek należy przechowywać w temperaturze pokojowej, nie zamrażać[87]. Zaraz po pobraniu z ampułki lek rozcieńcza się 100–250 ml glukozy 5% lub roztworem soli fizjologicznej. Trójtlenku arsenu nie należy mieszać, ani podawać w jednym wlewie z innymi lekami.
- W preparatyce recepturowej trójtlenek arsenu był stosowany w postaci rozcierki 1:10 z laktozą (Trituratio Acidi arsenicosi 1/10). W celu sporządzenia rozcierki w moździerzu umieszcza się jedną część trójtlenku arsenu i stale ucierając dodaje się porcjami 9 cz. laktozy. Otrzymanie równomiernie rozmieszanej rozcierki wymaga co najmniej 10-minutowego ucierania w moździerzu[2].
Przypisy
- ↑ a b c d e Arsen (trójtlenek arsenu), [w:] Indeks Leków MP [online], opis substancji, Medycyna Praktyczna [dostęp 2020-04-22].
- ↑ a b Feliks Modrzejewski: Farmacja stosowana, podręcznik dla studentów farmacji, wydanie V. Warszawa: Państwowy Zakład Wydawnictw Lekarskich, 1977, s. 384.
- ↑ pslgroup.com: FDA Grants Orphan Drug Designation To Trisenox (Arsenic Trioxide) For Treatment Of Chronic And Acute Myeloid Leukemia. [dostęp 2009-07-28]. [zarchiwizowane z tego adresu (11 maja 2008)]. (ang.).
- ↑ Agency for Toxic Substances and Disease Registry. Arsenic. sierpień 2007. [dostęp 2009-05-17]. (ang.).
- ↑ a b Aronson SM. Arsenic and old myths. „Rhode Island Medicine”. 7 (77), s. 233–4, 1994. PMID: 7919541.
- ↑ Siderov J., Duggan J. Arsenic Trioxide Associated Toothache. „Journal of oncology pharmacy practice : official publication of the International Society of Oncology Pharmacy Practitioners”, 2009. DOI: 10.1177/1078155209338727. PMID: 19525303.
- ↑ Wu Jinzhu: Development and evaluation of a novel nanoparticulate delivery system of arsenic sulfides (a thesis submitted for the degree of doctor of philosophy, Department of Pharmacy, National University of Singapore). core.ac.uk (Connecting Repositories), 2008. s. 4 (PDF: 24). [dostęp 2019-10-19]. (ang.).
- ↑ a b Antman KH. Introduction: the history of arsenic trioxide in cancer therapy. „The Oncologist”. 6 Suppl 2, s. 1–2, 2001. DOI: 10.1634/theoncologist.6-suppl_2-1. PMID: 11331433.
- ↑ Gensini GF., Conti AA., Lippi D., Ehrlich P. The contributions of Paul Ehrlich to infectious disease. „The Journal of Infection”. 3 (54), s. 221–224, 2007. DOI: 10.1016/j.jinf.2004.05.022. PMID: 16567000.
- ↑ Douer D., Tallman MS. Arsenic trioxide: new clinical experience with an old medication in hematologic malignancies. „Journal of clinical oncology : official journal of the American Society of Clinical Oncology”. 10 (23), s. 2396–410, 2005. DOI: 10.1200/JCO.2005.10.217. PMID: 15800332.
- ↑ Waxman S., Anderson KC. History of the development of arsenic derivatives in cancer therapy. „The oncologist”. 6 Suppl 2, s. 3–10, 2001. DOI: 10.1634/theoncologist.6-suppl_2-3. PMID: 11331434.
- ↑ Cutler EG., Bradford EH. Changes of the Globular Richness of Human Blood. „The Journal of Physiology”. 6 (1), s. 427–433, 1879. DOI: 10.1113/jphysiol.1879.sp000034. PMID: 16991244. PMCID: PMC1484689.
- ↑ Forkner CE., Scott TFM.. Arsenic as a therapeutic agent in chronic myelogenous leukemia. „Journal of Amercian Medical Association”. 97 (1), s. 3-5, 1931. DOI: 10.1001/jama.1931.02730010007002.
- ↑ Shen ZX., Chen GQ., Ni JH., Li XS., Xiong SM., Qiu QY., Zhu J., Tang W., Sun GL., Yang KQ., Chen Y., Zhou L., Fang ZW., Wang YT., Ma J., Zhang P., Zhang TD., Chen SJ., Chen Z., Wang ZY. Use of arsenic trioxide (As
2O
3) in the treatment of acute promyelocytic leukemia (APL): II. Clinical efficacy and pharmacokinetics in relapsed patients. „Blood”. 9 (89), s. 3354–3360, 1997. PMID: 9129042. - ↑ Niu C., Yan H., Yu T., Sun HP., Liu JX., Li XS., Wu W., Zhang FQ., Chen Y., Zhou L., Li JM., Zeng XY., Yang RR., Yuan MM., Ren MY., Gu FY., Cao Q., Gu BW., Su XY., Chen GQ., Xiong SM., Zhang TD., Waxman S., Wang ZY., Chen Z., Hu J., Shen ZX., Chen SJ. Studies on treatment of acute promyelocytic leukemia with arsenic trioxide: remission induction, follow-up, and molecular monitoring in 11 newly diagnosed and 47 relapsed acute promyelocytic leukemia patients. „Blood”. 10 (94), s. 3315–3324, 1999. PMID: 10552940.
- ↑ Shen Y., Shen ZX., Yan H., Chen J., Zeng XY., Li JM., Li XS., Wu W., Xiong SM., Zhao WL., Tang W., Wu F., Liu YF., Niu C., Wang ZY., Chen SJ., Chen Z. Studies on the clinical efficacy and pharmacokinetics of low-dose arsenic trioxide in the treatment of relapsed acute promyelocytic leukemia: a comparison with conventional dosage. „Leukemia”. 5 (15), s. 735–741, 2001. DOI: 10.1038/sj.leu.2402106. PMID: 11368433.
- ↑ Soignet SL., Maslak P., Wang ZG., Jhanwar S., Calleja E., Dardashti LJ., Corso D., DeBlasio A., Gabrilove J., Scheinberg DA., Pandolfi PP., Warrell RP. Complete remission after treatment of acute promyelocytic leukemia with arsenic trioxide. „The New England Journal of Medicine”. 19 (339), s. 1341–1348, 1998. DOI: 10.1056/NEJM199811053391901. PMID: 9801394.
- ↑ FDA approves arsenic trioxide for leukemia treatment in record time for a cancer drug development program. 26 sierpnia 2000. [dostęp 2009-05-17]. [zarchiwizowane z tego adresu (6 czerwca 2014)].
- ↑ Petros AM., Medek A., Nettesheim DG., Kim DH., Yoon HS., Swift K., Matayoshi ED., Oltersdorf T., Fesik SW. Solution structure of the antiapoptotic protein bcl-2. „Proceedings of the National Academy of Sciences of the United States of America”. 6 (98), s. 3012–7, 2001. DOI: 10.1073/pnas.041619798. PMID: 11248023.
- ↑ Ye H., Cande C., Stephanou NC., Jiang S., Gurbuxani S., Larochette N., Daugas E., Garrido C., Kroemer G., Wu H. DNA binding is required for the apoptogenic action of apoptosis inducing factor. „Nature Structural Biology”. 9 (9), s. 680–4, 2002. DOI: 10.1038/nsb836. PMID: 12198487.
- ↑ Riedl SJ., Li W., Chao Y., Schwarzenbacher R., Shi Y. Structure of the apoptotic protease-activating factor 1 bound to ADP. „Nature”. 7035 (434), s. 926–33, 2005. DOI: 10.1038/nature03465. PMID: 15829969.
- ↑ Crystal structure of human Bcl-2 family protein Bak. 2YV6
- ↑ Suzuki M., Youle RJ., Tjandra N. Structure of Bax: coregulation of dimer formation and intracellular localization. „Cell”. 4 (103), s. 645–654, 2000. DOI: 10.1016/S0092-8674(00)00167-7. PMID: 11106734.
- ↑ Moorthy AK., Huang DB., Wang VY., Vu D., Ghosh G. X-ray structure of a NF-kappaB p50/RelB/DNA complex reveals assembly of multiple dimers on tandem kappaB sites. „Journal of Molecular Biology”. 3 (373), s. 723–34, 2007. DOI: 10.1016/j.jmb.2007.08.039. PMID: 17869269.
- ↑ Asano Y., Kitamura S., Ohra T., Aso K., Igata H., Tamura T., Kawamoto T., Tanaka T., Sogabe S., Matsumoto S., Yamaguchi M., Kimura H., Itoh F. Discovery, synthesis and biological evaluation of isoquinolones as novel and highly selective JNK inhibitors (1). „Bioorganic & Medicinal Chemistry”. 8 (16), s. 4715–32, 2008. DOI: 10.1016/j.bmc.2008.02.027. PMID: 18313304.
- ↑ LeBlanc HN., Ashkenazi A. Apo2L/TRAIL and its death and decoy receptors. „Cell Death and Differentiation”. 1 (10), s. 66–75, 2003. DOI: 10.1038/sj.cdd.4401187. PMID: 12655296.
- ↑ Łabedzka K., Grzanka A., Izdebska M. Mitochondria a śmierć komórki. „Postępy Higieny i Medycyny Doświadczalnej (online)”, s. 439–446, 2006. PMID: 17013363.
- ↑ Bednarek J., Kiliańska ZM. Mitochondrial intermembrane space proteins in apoptosis process. „Postępy Biochemii”. 4 (51), s. 447–458, 2005. PMID: 16676580.
- ↑ Pop C., Salvesen GS. Human caspases: activation, specificity and regulation. „The Journal of Biological Chemistry”, 2009. DOI: R800084200 10.1074/jbc. R800084200. PMID: 19473994.
- ↑ Stępień A., Izdebska M., Grzanka A. Rodzaje śmierci komórki. „Postępy Higieny i Medycyny Doświadczalnej (online)”, s. 420–8, 2007. PMID: 17679912.
- ↑ Jing Y. The PML-RARalpha fusion protein and targeted therapy for acute promyelocytic leukemia. „Leukemia & Lymphoma”. 4 (45), s. 639–648, 2004. DOI: 10.1080/10428190310001609933. PMID: 15160934.
- ↑ Powell BL. Acute progranulocytic leukemia. „Current Opinion in Oncology”. 1 (13), s. 8–13, 2001. DOI: 10.1097/00001622-200101000-00003. PMID: 11148679.
- ↑ Hayakawa F., Privalsky ML. Phosphorylation of PML by mitogen-activated protein kinases plays a key role in arsenic trioxide-mediated apoptosis. „Cancer Cell”. 4 (5), s. 389–401, 2004. DOI: 10.1016/S1535-6108(04)00082-0. PMID: 15093545.
- ↑ Kang YH., Lee SJ. The role of p38 MAPK and JNK in Arsenic trioxide-induced mitochondrial cell death in human cervical cancer cells. „Journal of Cellular Physiology”. 1 (217), s. 23–33, 2008. DOI: 10.1002/jcp.21470. PMID: 18412143.
- ↑ Davison K., Mann KK., Waxman S., Miller WH. JNK activation is a mediator of arsenic trioxide-induced apoptosis in acute promyelocytic leukemia cells. „Blood”. 9 (103), s. 3496–502, 2004. DOI: 10.1182/blood-2003-05-1412. PMID: 14701702.
- ↑ a b Mathas S., Lietz A., Janz M., Hinz M., Jundt F., Scheidereit C., Bommert K., Dorken B. Inhibition of NF-kappaB essentially contributes to arsenic-induced apoptosis. „Blood”. 3 (102), s. 1028–34, 2003. DOI: 10.1182/blood-2002-04-1154. PMID: 12676792.
- ↑ Verma UN., Yamamoto Y., Prajapati S., Gaynor RB. Nuclear role of I kappa B Kinase-gamma/NF-kappa B essential modulator (IKK gamma/NEMO) in NF-kappa B-dependent gene expression. „The Journal of Biological Chemistry”. 5 (279), s. 3509–15, 2004. DOI: M309300200 10.1074/jbc. M309300200. PMID: 14597638.
- ↑ Kerbauy DM., Lesnikov V., Abbasi N., Seal S., Scott B., Deeg HJ. NF-kappaB and FLIP in arsenic trioxide (ATO)-induced apoptosis in myelodysplastic syndromes (MDSs). „Blood”. 12 (106), s. 3917–25, 2005. DOI: 10.1182/blood-2005-04-1424. PMID: 16105982.
- ↑ Miller WH., Schipper HM., Lee JS., Singer J., Waxman S. Mechanisms of action of arsenic trioxide. „Cancer Research”. 14 (62), s. 3893–3903, 2002. PMID: 12124315.
- ↑ Ai Z., Lu W., Qin X. Arsenic trioxide induces gallbladder carcinoma cell apoptosis via downregulation of Bcl-2. „Biochemical and Biophysical Research Communications”. 3 (348), s. 1075–81, 2006. DOI: 10.1016/j.bbrc.2006.07.181. PMID: 16904648.
- ↑ Chen GQ., Zhu J., Shi XG., Ni JH., Zhong HJ., Si GY., Jin XL., Tang W., Li XS., Xong SM., Shen ZX., Sun GL., Ma J., Zhang P., Zhang TD., Gazin C., Naoe T., Chen SJ., Wang ZY., Chen Z. In vitro studies on cellular and molecular mechanisms of arsenic trioxide (As
2O
3) in the treatment of acute promyelocytic leukemia: As
2O
3 induces NB4 cell apoptosis with downregulation of Bcl-2 expression and modulation of PML-RAR alpha/PML proteins. „Blood”. 3 (88), s. 1052–1061, 1996. PMID: 8704214. - ↑ Freitas RA., Silva dos Santos GA., Gimenes Teixeira HL., Scheucher PS., Lucena-Araujo AR., Lima AS., Abreu e Lima RS., Garcia AB., Jordão AA., Falcão RP., Vannucchi H., Rego EM. Apoptosis induction by (+)alpha-tocopheryl succinate in the absence or presence of all-trans retinoic acid and arsenic trioxide in NB4, NB4-R2 and primary APL cells. „Leukemia Research”. 7 (33), s. 958–63, 2009. DOI: 10.1016/j.leukres.2008.09.035. PMID: 19013639.
- ↑ Kitamura K., Minami Y., Yamamoto K., Akao Y., Kiyoi H., Saito H., Naoe T. Involvement of CD95-independent caspase 8 activation in arsenic trioxide-induced apoptosis. „Leukemia”. 10 (14), s. 1743–1750, 2000. DOI: 10.1038/sj.leu.2401900. PMID: 11021749.
- ↑ Zhu J., Okumura H., Ohtake S., Nakamura S., Nakao S. Arsenic trioxide induces apoptosis in leukemia/lymphoma cell lines via the CD95/CD95L system. „Oncology Reports”. 3 (10). s. 705–709. DOI: 10.3892/or.10.3.705. PMID: 12684647.
- ↑ a b Liu Q., Hilsenbeck S., Gazitt Y. Arsenic trioxide-induced apoptosis in myeloma cells: p53-dependent G1 or G2/M cell cycle arrest, activation of caspase-8 or caspase-9, and synergy with APO2/TRAIL. „Blood”. 10 (101), s. 4078–87, 2003. DOI: 10.1182/blood-2002-10-3231. PMID: 12531793.
- ↑ Szegezdi E., Cahill S., Meyer M., O'Dwyer M., Samali A. TRAIL sensitisation by arsenic trioxide is caspase-8 dependent and involves modulation of death receptor components and Akt. „British Journal of Cancer”. 3 (94), s. 398–406, 2006. DOI: 10.1038/sj.bjc.6602954. PMID: 16434995.
- ↑ Coe E., Schimmer AD. Catalase activity and arsenic sensitivity in acute leukemia. „Leukemia & Lymphoma”. 10 (49), s. 1976–81, 2008. DOI: 10.1080/10428190802353617. PMID: 18949620.
- ↑ Cheng YH., Ou BR., Cheng LC., Lu JH., Yeh JY. Glutathione regulation in arsenic-induced porcine aortic endothelial cells. „Toxicology in vitro: An International Journal Published in association with BIBRA”. 8 (22), s. 1832–9, 2008. DOI: 10.1016/j.tiv.2008.08.006. PMID: 18801422.
- ↑ Bilska A., Kryczyk A., Włodek L. Różne oblicza biologicznej roli glutationu. „Postępy Higieny i Medycyny Doświadczalnej (online)”, s. 438–453, 2007. PMID: 17679914.
- ↑ Ishitsuka K., Ikeda R., Utsunomiya A., Uozumi K., Hanada S., Suzuki S., Takeuchi S., Takatsuka Y., Takeshita T., Ohno N., Arima T. Arsenic trioxide induces apoptosis in HTLV-I infected T-cell lines and fresh adult T-cell leukemia cells through CD95 or tumor necrosis factor alpha receptor independent caspase activation. „Leukemia & Lymphoma”. 5 (43), s. 1107–14, 2002. PMID: 12148893.
- ↑ Zhao S., Zhang J., Zhang X., Dong X., Sun X. Arsenic trioxide induces different gene expression profiles of genes related to growth and apoptosis in glioma cells dependent on the p53 status. „Molecular Biology Reports”. 3 (35), s. 421–9, 2008. DOI: 10.1007/s11033-007-9102-6. PMID: 17530438.
- ↑ Izdebska M., Grzanka A., Szczepański MA., Litwiniec A. Wybrane mechanizmy terapeutycznego oddziaływania trójtlenku arsenu w leczeniu nowotworów. „Postępy Higieny i Medycyny Doświadczalnej (online)”, s. 463–7, 2008. PMID: 18806735.
- ↑ Hussein MA., Saleh M., Ravandi F., Mason J., Rifkin RM., Ellison R. Phase 2 study of arsenic trioxide in patients with relapsed or refractory multiple myeloma. „British Journal of Haematology”. 4 (125), s. 470–6, 2004. DOI: 10.1111/j.1365-2141.2004.04941.x. PMID: 15142117.
- ↑ Soignet SL., Frankel SR., Douer D., Tallman MS., Kantarjian H., Calleja E., Stone RM., Kalaycio M., Scheinberg DA., Steinherz P., Sievers EL., Coutré S., Dahlberg S., Ellison R., Warrell RP. United States multicenter study of arsenic trioxide in relapsed acute promyelocytic leukemia. „Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology”. 18 (19), s. 3852–60, 2001. PMID: 11559723.
- ↑ Fox E., Razzouk BI., Widemann BC., Xiao S., O'Brien M., Goodspeed W., Reaman GH., Blaney SM., Murgo AJ., Balis FM., Adamson PC. Phase 1 trial and pharmacokinetic study of arsenic trioxide in children and adolescents with refractory or relapsed acute leukemia, including acute promyelocytic leukemia or lymphoma. „Blood”. 2 (111), s. 566–73, 2008. DOI: 10.1182/blood-2007-08-107839. PMID: 17959855.
- ↑ Kim HR., Kim EJ., Yang SH., Jeong ET., Park C., Kim SJ., Youn MJ., So HS., Park R. Combination treatment with arsenic trioxide and sulindac augments their apoptotic potential in lung cancer cells through activation of caspase cascade and mitochondrial dysfunction. „International Journal of Oncology”. 6 (28), s. 1401–8, 2006. PMID: 16685442.
- ↑ Qazilbash MH., Saliba RM., Nieto Y., Parikh G., Pelosini M., Khan FB., Jones RB., Hosing C., Mendoza F., Weber DM., Wang M., Popat U., Alousi A., Anderlinii P., Champlin RE., Giralt S. Arsenic trioxide with ascorbic acid and high-dose melphalan: results of a phase II randomized trial. „Biology of Blood and Marrow Transplantation: Journal of the American Society for Blood and Marrow Transplantation”. 12 (14), s. 1401–7, 2008. DOI: 10.1016/j.bbmt.2008.09.019. PMID: 19041063.
- ↑ Campbell RA., Sanchez E., Steinberg JA., Baritaki S., Gordon M., Wang C., Shalitin D., Chen H., Pang S., Bonavida B., Said J., Berenson JR. Antimyeloma effects of arsenic trioxide are enhanced by melphalan, bortezomib and ascorbic acid. „British Journal of Haematology”. 4 (138), s. 467–78, 2007. DOI: 10.1111/j.1365-2141.2007.06675.x. PMID: 17587338.
- ↑ Bornstein J., Sagi S., Haj A., Harroch J., Fares F. Arsenic Trioxide inhibits the growth of human ovarian carcinoma cell line. „Gynecologic Oncology”. 3 (99), s. 726–9, 2005. DOI: 10.1016/j.ygyno.2005.07.125. PMID: 16243384.
- ↑ Shao QS., Ye ZY., Ling ZQ., Ke JJ. Cell cycle arrest and apoptotic cell death in cultured human gastric carcinoma cells mediated by arsenic trioxide. „World Journal of Gastroenterology”. 22 (11), s. 3451–6, 2005. PMID: 15948253.
- ↑ Uslu R., Sanli UA., Sezgin C., Karabulut B., Terzioglu E., Omay SB., Goker E. Arsenic trioxide-mediated cytotoxicity and apoptosis in prostate and ovarian carcinoma cell lines. „Clinical Cancer Research: An Official Journal of the American Association for Cancer Research”. 12 (6), s. 4957–64, 2000. PMID: 11156257.
- ↑ Zhao S., Zhang X., Zhang J., Zhang J., Zou H., Liu Y., Dong X., Sun X. Intravenous administration of arsenic trioxide encapsulated in liposomes inhibits the growth of C6 gliomas in rat brains. „Journal of Chemotherapy”. 2 (20), s. 253–62, 2008. PMID: 18467254.
- ↑ Wang W., Adachi M., Zhang R., Zhou J., Zhu D. A novel combination therapy with arsenic trioxide and parthenolide against pancreatic cancer cells. „Pancreas”. 4 (38), s. e114–23, 2009. DOI: 10.1097/MPA.0b013e3181a0b6f2. PMID: 19342982.
- ↑ Chen H., Ahn R., Van den Bossche J., Thompson DH., O'Halloran TV. Folate-mediated intracellular drug delivery increases the anticancer efficacy of nanoparticulate formulation of arsenic trioxide. „Molecular cancer therapeutics”. 7 (8), s. 1955–63, 2009. DOI: 10.1158/1535-7163.MCT-09-0045. PMID: 19567824.
- ↑ Bobé P., Bonardelle D., Benihoud K., Opolon P., Chelbi-Alix MK. Arsenic trioxide: A promising novel therapeutic agent for lymphoproliferative and autoimmune syndromes in MRL/lpr mice. „Blood”. 13 (108), s. 3967–75, 2006. DOI: 10.1182/blood-2006-04-020610. PMID: 16926289.
- ↑ a b c drugs.com: Arsenic Trioxide. [dostęp 2009-07-25]. (ang.).
- ↑ Yoshino Y., Yuan B., Miyashita SI., Iriyama N., Horikoshi A., Shikino O., Toyoda H., Kaise T. Speciation of arsenic trioxide metabolites in blood cells and plasma of a patient with acute promyelocytic leukemia. „Analytical and Bioanalytical Chemistry”. 2 (393), s. 689–97, 2009. DOI: 10.1007/s00216-008-2487-9. PMID: 19009285.
- ↑ Carter DE., Aposhian HV., Gandolfi AJ. The metabolism of inorganic arsenic oxides, gallium arsenide, and arsine: a toxicochemical review. „Toxicology and Applied Pharmacology”. 3 (193), s. 309–34, 2003. DOI: 10.1016/j.taap.2003.07.009. PMID: 14678742.
- ↑ Ni J., Chen G., Shen Z., Li X., Liu H., Huang Y., Fang Z., Chen S., Wang Z., Chen Z. Pharmacokinetics of intravenous arsenic trioxide in the treatment of acute promyelocytic leukemia. „Chinese Medical Journal”. 12 (111), s. 1107–10, 1998. PMID: 11263375.
- ↑ Fujisawa S., Ohno R., Shigeno K., Sahara N., Nakamura S., Naito K., Kobayashi M., Shinjo K., Takeshita A., Suzuki Y., Hashimoto H., Kinoshita K., Shimoya M., Kaise T., Ohnishi K. Pharmacokinetics of arsenic species in Japanese patients with relapsed or refractory acute promyelocytic leukemia treated with arsenic trioxide. „Cancer Chemotherapy and Pharmacology”. 4 (59), s. 485–93, 2007. DOI: 10.1007/s00280-006-0288-4. PMID: 16937107.
- ↑ Thomas X., Pigneux A., Raffoux E., Huguet F., Caillot D., Fenaux P. Superiority of an arsenic trioxide-based regimen over a historic control combining all-trans retinoic acid plus intensive chemotherapy in the treatment of relapsed acute promyelocytic leukemia. „Haematologica”. 7 (91), s. 996–7, 2006. PMID: 16757416.
- ↑ Au WY., Kwong YL. Arsenic trioxide: safety issues and their management. „Acta Pharmacologica Sinica”. 3 (29), s. 296–304, 2008. PMID: 18298894.
- ↑ Abou-Jawde RM., Reed J., Kelly M., Walker E., Andresen S., Baz R., Karam MA., Hussein M. Efficacy and safety results with the combination therapy of arsenic trioxide, dexamethasone, and ascorbic acid in multiple myeloma patients: a phase 2 trial. „Medical Oncology (Northwood, London, England)”. 2 (23), s. 263–72, 2006. DOI: 10.1385/MO:23:2:263. PMID: 16720927.
- ↑ Vizzardi E., Zanini G., Antonioli E., D'Aloia A., Raddino R., Cas LD. QT prolongation: a case of arsenical pericardial and pleural effusion. „Cardiovascular Toxicology”. 1 (8), s. 41–4, 2008. DOI: 10.1007/s12012-007-9009-4. PMID: 18084726.
- ↑ Naito K., Kobayashi M., Sahara N., Shigeno K., Nakamura S., Shinjo K., Tobita T., Takeshita A., Ohno R., Ohnishi K. Two cases of acute promyelocytic leukemia complicated by torsade de pointes during arsenic trioxide therapy. „International Journal of Hematology”. 4 (83), s. 318–23, 2006. DOI: 10.1532/IJH97.05056. PMID: 16757431.
- ↑ Chanan-Khan A., Srinivasan S., Czuczman MS. Prevention and management of cardiotoxicity from antineoplastic therapy. „The Journal of Supportive Oncology”. 3 (2). s. 251–6; discussion 259–61, 264–6. PMID: 15328825.
- ↑ Unnikrishnan D., Dutcher JP., Garl S., Varshneya N., Lucariello R., Wiernik PH. Cardiac monitoring of patients receiving arsenic trioxide therapy. „British Journal of Haematology”. 5 (124), s. 610–7, 2004. PMID: 14871247.
- ↑ Ohnishi K., Yoshida H., Shigeno K., Nakamura S., Fujisawa S., Naito K., Shinjo K., Fujita Y., Matsui H., Sahara N., Takeshita A., Satoh H., Terada H., Ohno R. Arsenic trioxide therapy for relapsed or refractory Japanese patients with acute promyelocytic leukemia: need for careful electrocardiogram monitoring. „Leukemia: Official Journal of the Leukemia Society of America, Leukemia Research Fund, U.K”. 4 (16), s. 617–22, 2002. DOI: 10.1038/sj.leu.2402426. PMID: 11960341.
- ↑ Cashin R., Burry L., Peckham K., Reynolds S., Seki JT. Acute renal failure, gastrointestinal bleeding, and cardiac arrhythmia after administration of arsenic trioxide for acute promyelocytic leukemia. „American Journal of Health-System Pharmacy: Official Journal of the American Society of Health-System Pharmacists”. 10 (65), s. 941–6, 2008. DOI: 10.2146/ajhp060616. PMID: 18463343.
- ↑ Yamazaki K., Terada H., Satoh H., Naito K., Takeshita A., Uehara A., Katoh H., Ohnishi K., Hayashi H. Arrhythmogenic effects of arsenic trioxide in patients with acute promyelocytic leukemia and an electrophysiological study in isolated guinea pig papillary muscles. „Circulation Journal: Official Journal of the Japanese Circulation Society”. 11 (70), s. 1407–14, 2006. PMID: 17062962.
- ↑ Jones RL., Ewer MS. Cardiac and cardiovascular toxicity of nonanthracycline anticancer drugs. „Expert Review of Anticancer Therapy”. 9 (6), s. 1249–69, 2006. DOI: 10.1586/14737140.6.9.1249. PMID: 17020459.
- ↑ Rust DM., Soignet SL. Risk/benefit profile of arsenic trioxide. „The Oncologist”, s. 29–32, 2001. PMID: 11331438.
- ↑ Levy M., Wofford MM., Powell BL., McLean TW. Hyperleukocytosis from arsenic trioxide. „Pediatric Blood & Cancer”. 6 (50), s. 1265–7, 2008. DOI: 10.1002/pbc.21532. PMID: 18300308.
- ↑ Roberts TF., Sprague K., Schenkein D., Miller KB., Relias V. Hyperleukocytosis during induction therapy with arsenic trioxide for relapsed acute promyelocytic leukemia associated with central nervous system infarction. „Blood”. 12 (96), s. 4000–1, 2000. PMID: 11186272.
- ↑ Thery JC., Jardin F., Massy N., Massy J., Stamatoullas A., Tilly H. Optical neuropathy possibly related to arsenic during acute promyelocytic leukemia treatment. „Leukemia & Lymphoma”. 1 (49), s. 168–70, 2008. DOI: 10.1080/10428190701757843. PMID: 18203030.
- ↑ Alimoghaddam K., Ghavamzadeh A., Jahani M. Use of Novoseven for arsenic trioxide-induced bleeding in PML. „American Journal of Hematology”. 9 (81), s. 720, 2006. DOI: 10.1002/ajh.20713. PMID: 16804937.
- ↑ a b drugs.com: Trisenox. [dostęp 2009-07-25]. (ang.).
- ↑ Wang EE., Mahajan N., Wills B., Leikin J. Successful treatment of potentially fatal heavy metal poisonings. „The Journal of Emergency Medicine”. 3 (32), s. 289–94, 2007. DOI: 10.1016/j.jemermed.2006.12.013. PMID: 17394994.
- ↑ Kim LH., Abel SJ. Survival after a massive overdose of arsenic trioxide. „Critical Care and Resuscitation: Journal of the Australasian Academy of Critical Care Medicine”. 1 (11), s. 42–5, 2009. PMID: 19281444.
- ↑ Korístek Z., Zák P. Coagulopathy and differentiation syndrome: the main complications of the initial treatment of acute promyelocytic leukemia. „Vnitr̆ní Lékar̆ství”. 7-8 (54). s. 745–50. PMID: 18780573.
- ↑ Kreppel H., Paepcke U., Thiermann H., Szinicz L., Reichl FX., Singh PK., Jones MM. Therapeutic efficacy of new dimercaptosuccinic acid (DMSA) analogues in acute arsenic trioxide poisoning in mice. „Archives of Toxicology”. 8 (67), s. 580–5, 1993. PMID: 7506906.
- ↑ Blythe D., Joyce DA. Clearance of arsenic by haemodialysis after acute poisoning with arsenic trioxide. „Intensive Care Medicine”. 1 (27), s. 334, 2001. PMID: 11280669.
- ↑ a b c RxList: Trisenox. ostatnia aktualizacja 21 lipca 2008. [dostęp 2009-07-25]. (ang.).
Bibliografia
- Charakterystyka produktu leczniczego Trisenox. 29 kwietnia 2009. [dostęp 2009-05-30]. (pol.).
- Informacje o leku w DrugBank. [dostęp 2009-05-30]. [zarchiwizowane z tego adresu (2019-01-31)]. (ang.).
- Paul C. Ho: 33As Metallotherapeutic Arsenic Compounds. W: Metallotherapeutic drugs and metal-based diagnostic agents. The use of metals in medicine. Marcel Gielen, Edward R.T. Tiekink (red.). Hoboken, N.J.: John Wiley & Sons Inc., 2005, s. 297-309. DOI: 10.1002/0470864052.ch16. ISBN 0-470-86403-6.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Struktura białka Bax
Struktura NF-kB
Struktura białka Bcl-2
Struktura APAF1
Mechanizm działania trójtlenku arsenu - indukcja apoptozy
Struktura kinazy JNK
Struktura czynnika AIF
Struktura białka Bak