Chemia organiczna
Chemia organiczna – dziedzina chemii zajmująca się badaniem budowy, właściwości oraz reakcji związków chemicznych zawierających węgiel, a także opracowywaniem różnorodnych metod syntezy tych połączeń. Ponadto związki organiczne zawierać mogą atomy innych pierwiastków, takich jak wodór, tlen, azot, fosfor, krzem oraz siarka[1][2][3].
Chemia organiczna i nieorganiczna
Termin chemia organiczna oznaczał pierwotnie dział chemii zajmujący się systematyką oraz badaniem własności związków organicznych, które, jak wierzono, nie mogą być otrzymane na drodze syntezy laboratoryjnej, a jedynie przez żywe organizmy.
Później okazało się jednak, że niemal wszystkie związki chemiczne produkowane przez organizmy żywe da się też sztucznie zsyntezować. Udało się następnie otrzymać wiele związków, które w naturze nie występują, ale których własności są zbliżone do tych produkowanych przez organizmy żywe. Ponadto samo życie zależy w znacznym stopniu od związków nieorganicznych. Bardzo wiele enzymów i innych białek takich jak hemoglobina wymaga do swojej aktywności obecności jonów metali przejściowych.
Obecnie nauką, która zajmuje się badaniem związków chemicznych występujących w żywych organizmach oraz ich przemianami jest biochemia, która jest powiązana zarówno z chemią organiczną jak i wieloma dyscyplinami biologii.
Z drugiej strony okazało się, że wszystkie związki organiczne zawierają węgiel czterowartościowy (pomijając dwutlenek węgla i cyjanki, będące zw. nieorganicznymi), stąd obecnie definicja chemii organicznej to chemia wszystkich tych związków węgla, którymi nie zajmowała się wcześniej tradycyjna chemia nieorganiczna. Z powodu ogromnej liczby możliwych do otrzymania związków zawierających złożony szkielet węglowy mogą one posiadać bardzo różnorodne właściwości oraz zastosowania. Przykładowo praktycznie wszystkie stosowane obecnie barwniki, tworzywa sztuczne oraz leki to związki organiczne.
Historia chemii organicznej
Na początku XIX wieku powszechnie uważano, że związki chemiczne występujące w żywych organizmach są zbyt złożone, by można było je otrzymać na drodze syntezy chemicznej wychodzącej od prostych związków nieorganicznych. Ponadto zgodnie z założeniami witalizmu wierzono, że wiele procesów zachodzących w żywych organizmach możliwych jest dzięki istnieniu "siły życiowej", a zatem niemożliwe jest ich przeprowadzenie poza organizmem.
Znaczące przyspieszenie rozwoju tej dyscypliny miało miejsce w czasie, gdy uświadomiono sobie, że związki organiczne mogą zostać otrzymane na drodze syntezy laboratoryjnej bez posługiwania się "siłą życiową". W 1816 Michel Eugène Chevreul prowadził badania nad składem mydła i właściwościami występujących tam soli kwasów tłuszczowych. Po wydzieleniu i oczyszczeniu z produktów naturalnych różnych kwasów tłuszczowych oraz przereagowaniu ich z silnymi zasadami nieorganicznymi otrzymał mydło, co stanowiło dowód, że poprzez prowadzenie reakcji chemicznych na tłuszczach możliwe jest otrzymanie nowych złożonych substancji bez wykorzystania "siły życiowej". Natomiast w 1828 Friedrich Wöhler przeprowadził syntezę mocznika, będącego składnikiem moczu z wykorzystaniem cyjanianu amonu NH4OCN. Reakcja ta stanowiła punkt zwrotny w historii chemii organicznej i zapoczątkowała dalsze syntezy coraz bardziej skomplikowanych związków występujących w naturze.
Kolejny znaczący przełom miał miejsce w 1856, gdy William Henry Perkin przypadkowo otrzymał barwnik organiczny, nazwany później purpurą Perkina. Z powodu dużego znaczenia praktycznego barwnik ten zapewnił Perkinowi bogactwo i wywołał znacznie większe zainteresowanie chemią organiczną. Podobny efekt wywołało odkrycie owadobójczych właściwości DDT, otrzymanego przez Othmera Zeidlera w 1874.
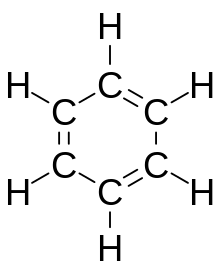
Teoretyczne podstawy struktury związków organicznych zostały sformułowane niezależnie przez dwóch naukowców: Friedricha Augusta Kekulego oraz Archibalda Scotta Coupera w 1858. Badacze ci zasugerowali, że czterowiązalne atomy węgla zdolne są do formowania trójwymiarowej siatki (struktura diamentu) a dokładny wzór chemiczny danego związku może zostać wydedukowany na podstawie dokładnej analizy reakcji chemicznych, którym on podlega. Ponadto Kekule jest odkrywcą poprawnej struktury benzenu. Przed jego interpretacją, zakładającą istnienie aromatycznego pierścienia sześcioczłonowego istniało kilka innych proponowanych wzorów strukturalnych dla tego węglowodoru, z których każdy charakteryzował się poprawną stechiometrią.
W drugiej połowie XIX wieku prowadzono wiele badań nad ropą naftową. Rozwój aparatury chemicznej pozwolił na przeprowadzenie destylacji frakcyjnej ropy i wyizolowanie podstawowych frakcji. Dokładniejsze badania nad każdą z frakcji doprowadziły do powstania przemysłu petrochemicznego i opracowania wielu nowych materiałów takich jak syntetyczna guma i tworzywa sztuczne.
Większa dostępność prostych węglowodorów i innych związków organicznych otrzymywanych z ropy naftowej gwałtownie przyśpieszyło rozwój syntezy organicznej, co doprowadziło do powstania syntetycznych chemioterapeutyków. Jednym z pierwszych masowo produkowanych leków był kwas acetylosalicylowy. Salwarsan, będący zawierającym arsen związkiem stosowanym w leczeniu kiły, był z kolei pierwszym systematycznie udoskonalanym lekiem. Paul Ehrlich syntetyzował wiele związków arsenoorganicznych o podobnym szkielecie węglowym, poszukując substancji o największej efektywności i najmniejszej szkodliwości.
Większość wcześnie odkrytych związków lub reakcji organicznych stanowiła dzieło przypadku, a nie zaplanowanych eksperymentów. Dopiero w XX wieku opracowanie nowych reakcji chemicznych pozwoliło na specyficzną syntezę wybranych związków organicznych, z których wiele cechowała się znacznie bardziej złożoną strukturą cząsteczek, niż wcześniej otrzymywane związki. Przeprowadzono również wiele syntez totalnych związków naturalnych takich jak penicylina, chlorofil czy kobalamina. Do otrzymania tych związków konieczne było wynalezienie wielu nowych reakcji chemicznych oraz metod pozwalających na syntezę określonych stereoizomerów. Ponadto synteza cząsteczek organicznych o dużej złożoności wymaga opracowania odpowiedniej strategii syntezy organicznej. Duże osiągnięcia na tym polu odniósł E.A. Corey. Jest on twórcą koncepcji retrosyntezy, która obecnie odgrywa podstawową rolę w projektowaniu syntez złożonych związków organicznych[4].
Od drugiej połowy XX wieku prawdopodobnie najważniejszym zagadnieniem w chemii jest kontrola stereochemii reakcji. Aktywność biologiczna praktycznie wszystkich związków chemicznych jest zależna od obecności centrów stereogenicznych o odpowiedniej konfiguracji absolutnej. Dlatego kwestia stereoselektywnej syntezy jednego z wielu możliwych stereoizomerów ma decydujące znaczenie w syntezie związków czynnych biologicznie.
Właściwości związków organicznych
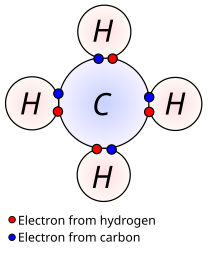
W przeważającej większości przypadków wiązania występujące w związkach organicznych są wiązaniami kowalencyjnymi. Ponieważ węgiel wykazuje zdolność do tworzenia stabilnych wiązań pomiędzy swoimi atomami (proces ten nazywany jest katenacją), możliwe jest powstawanie długich łańcuchów oraz pierścieni zbudowanych z atomów węgla. Ponadto możliwe jest formowanie się wiązań podwójnych oraz potrójnych, których obecność prowadzi do zwiększenia stopnia nienasycenia związku.
W odróżnieniu od związków nieorganicznych znaczna część związków organicznych w temperaturach powyżej 300 °C ulega topnieniu, sublimacji lub rozkładowi. Obojętne związki organiczne wykazują z reguły niską rozpuszczalność w wodzie, a dużo lepiej rozpuszczają się w rozpuszczalnikach organicznych. Wyjątkami od tej reguły są związki organiczne o charakterze jonowym, takie jak sole kwasów karboksylowych, czwartorzędowe sole amoniowe lub aminokwasy oraz niektóre związki o małej masie molowej, takie jak kwas octowy czy formaldehyd
Inne związki organiczne rozpuszczają się w rozpuszczalnikach organicznych, będących albo czystymi substancjami chemicznymi takimi jak metanol czy toluen lub ich mieszaninami. Rozpuszczalność danego związku w określonych rozpuszczalnikach zależy od występowania w cząsteczce tego związku różnych grup funkcyjnych, a także od budowy szkieletu węglowego. Badaniami procesów rozpuszczania się związków oraz zjawiskami zachodzącymi podczas tego procesu zajmuje się chemia fizyczna.
Podobnie jak wiele związków nieorganicznych dużo substancji organicznych może formować kryształy. Zazwyczaj są to kryształy molekularne o znacznie niższej stabilności niż kryształy jonowe lub kryształy atomowe.
Klasyfikacja związków organicznych
Nomenklatura
Dokonanie klasyfikacji nie jest możliwe bez posiadania pełnego opisu struktury związku. W przypadku prostych związków nieorganicznych charakterystyka związku może zostać dokonana przez podanie jego wzoru sumarycznego, zawierającego informacje o pierwiastkach występujących w związku oraz ich stechiometrii. Jednak zarówno nieorganiczne związki kompleksowe jak i substancje organiczne wymagają znajomości wzoru strukturalnego oddającego względne rozmieszczenie atomów w cząsteczce.
W chemii organicznej zwykle dokonuje się tego przez podanie wzoru strukturalnego. Z powodu znacznego stopnia złożoności cząsteczek organicznych konieczne było opracowanie uniwersalnej konwencji zapisu wzorów cząsteczek. Obecnie panuje tendencja do przedstawiania szkieletów węglowych pod postacią kresek, symbolami oznacza się jedynie atomy inne niż węgla i wodoru oraz grupy funkcyjne. W systemie tym każdy koniec linii oznacza ponadto grupę metylową.
Główną wadą systemu bazującego na strukturze są problemy ze słownym opisem tych wzorów. Dlatego też zaistniała potrzeba opracowania uniwersalnej nomenklatury, pozwalającej na nazwanie każdego hipotetycznego związku organicznego, niezależnie od stopnie skomplikowania jego cząsteczki. Historycznie pierwszym systemem nazewnictwa była Nomenklatura Genewska powstała po serii spotkań chemików organicznych w 1892 roku
Ponieważ w pierwszej połowie XX wieku znacznie wzrosła różnorodność otrzymywanych substancji to uświadomiono sobie, że konieczna jest modyfikacja systemu nazewnictwa. Zadania tego podjęła się Międzynarodowa Unia Chemii Czystej i Stosowanej IUPAC. Z powodu różnorodności związków organicznych (zwłaszcza produktów naturalnych) w ramach IUPAC powołano specjalną jednostkę nazwaną Międzynarodową Unią Biochemii i Biologii Molekularnej, IUBMB w celu zajęcia się tym problemem. W połowie XX wieku IUPAC zaczęła rekomendować bardziej uproszczone nazewnictwo. W 1951 cykliczna struktura benzenu została zaklasyfikowana jako cyklofan. Następne zalecenia rozszerzyły ten trend w kierunku innych złożonych systemów cyklicznych (także dla związków heterocyklicznych by nazywać takie połączenia fanami
Węglowodory i grupy funkcyjne

Klasyfikacja związków organicznych zaczyna się od węglowodorów ponieważ są one najprostszymi związkami organicznymi. Inne związki organiczne charakteryzują się obecnością przynajmniej jednej grupy funkcyjnej, które determinują właściwości fizykochemiczne związku organicznego. Klasa związków posiadająca daną grupę funkcyjną charakteryzuje się podobnymi właściwościami takimi jak: rozpuszczalność w wodzie i innych rozpuszczalnikach, kwasowość, reaktywność chemiczna, odporność na utlenianie itp.
Niektóre pierwiastki stanowiące elementy grup funkcyjnych takie jak fluorowce, S czy O mogą same pełnić rolę grupy funkcyjnej ponieważ w znaczący sposób modyfikują właściwości związku, który je zawiera (w porównaniu do węglowodoru o analogicznym szkielecie węglowym) ponadto ich specyficzny efekt jest powtarzalny i umożliwia on zaklasyfikowanie związków posiadających taką grupę funkcyjną do określonej klasy.
Związki alifatyczne
W ogólności związek alifatyczny charakteryzuje się obecnością jedynie łańcuchów węglowych w swojej strukturze, a brakiem ugrupowań o charakterze pierścieni.
Węglowodory alifatyczne są podzielone na trzy podstawowe grupy szeregów homologicznych, nawiązujące do stopnia nasycenia wiązań pomiędzy atomami węgla:
- alkany, nazywane także parafinami (jest to nazwa historyczna, obecnie rzadko stosowana), nie posiadają w swojej strukturze żadnych wiązań podwójnych ani potrójnych
- alkeny posiadają przynajmniej jedno wiązanie podwójne
- alkiny posiadają co najmniej jedno wiązanie potrójne
Zarówno alkeny jak i alkiny mogą posiadać kilka wiązań wielokrotnych, ponadto w jednej cząsteczce węglowodoru mogą znajdować się zarówno wiązanie podwójne jak i potrójne. Związki posiadające grupy funkcyjne są klasyfikowane raczej w oparciu o występowanie w nich grup funkcyjnych, niż obecność wiązań wielokrotnych.
Związki alicykliczne i aromatyczne
Związki cykliczne dzielą się na związki acykliczne oraz związki aromatyczne, węglowodory aromatyczne nazywane są arenami i z uwagi na obecność zdelokalizowanej chmury elektronów π posiadają inne właściwości. Układ aromatyczny jest znacznie bardziej stabilny, niż wynikałoby to z obecności w nim określonej ilości wiązań podwójnych. Wiązania te są jednak ze sobą skoniungowane, co prowadzi do dodatkowej stabilizacji układu, czego miernikiem jest mniejsza obserwowalna entalpia spalania niż obliczona teoretycznie dla niearomatycznego cyklicznego polialkenu.
Podobnie jak w przypadku związków alifatycznych, alicykliczne pierścienie węglowe mogą być nasycone lub nienasycone. Węglowodory alicykliczne posiadające jedynie pojedyncze wiązania C-C nazywane są cykloalkanami, których najprostszym przedstawicielem jest cyklopropan. Natomiast cykloalkeny i cykloalkiny posiadają odpowiednio wiązania podwójne i potrójne. Z powodów geometrycznych najbardziej stabilne są pierścienie zbudowane z sześciu atomów węgla (najmniejsze naprężenia dla wiązań w cząsteczce), układy złożone z pięciu atomów węgla także są stabilne. Pierścienie złożone z innej liczby atomów węgla są znacznie rzadziej spotykane.
Węglowodory aromatyczne posiadają układ zdelokalizowanych wiązań podwójnych w obrębie pierścienia węglowego. Najprostszym związkiem aromatycznym jest benzen, którego sześcioczłonowy pierścień aromatyczny stanowi element wielu cząsteczek organicznych. Dla "klasycznych" związków cyklicznych kryterium aromatyczności jest występowanie 4n + 2 zdelokalizowanych elektronów π, gdzie n jest liczbą naturalną. Z kolei obecność 4n elektronów π prowadzi do wzrostu niestabilności struktury. Takie układy nazywane są antyaromatycznymi.

Wprowadzenie heteroatomów do pierścienia węglowego prowadzi do znacznych zmian w jego własnościach. Związki posiadające tego rodzaju pierścienie nazywane są związkami heterocyklicznymi. Do prostych aromatycznych związków heterocyklicznych można zaliczyć piran, furan, tiofen oraz pirydynę natomiast piperydyna oraz tetrahydrofuran stanowią przykłady związków alicyklicznych. Najczęściej spotykanymi heteroatomami są azot, tlen oraz siarka, do rzadziej spotykanych można zaliczyć krzem oraz fosfor.
Pierścienie węglowe mogą się łączyć ze sobą, prowadząc do powstania związków policyklicznych. Układy takie często spotykane są w organizmach żywych. Do istotnych związków policyklicznych o znaczeniu biologicznym można zaliczyć oparte na szkielecie purynowym zasady azotowe budujące nukleotydy oraz wiele terpenoidów. Pierścienie mogą też wiązać się ze sobą wspólnym atomem węgla, co prowadzi do formowania się spiranów.
Polimery
Z punktu widzenia chemii organicznej najważniejszą cechą atomów węgla jest zdolność do katenacji, czyli tworzenia połączeń pomiędzy atomami tego samego pierwiastka. Ponadto bardzo wiele związków organicznych może w odpowiednich warunkach łączyć się ze sobą, tworząc ogromne makromolekuły o prostym lub rozgałęzionym łańcuchu. Proces formowania się łańcucha polimeru nazywany jest polimeryzacją, natomiast mianem monomeru określana jest najmniejsza powtarzalna jednostka występująca w łańcuchu polimeru. Istnieją dwie główne klasy polimerów organicznych: plastiki, nazywane też polimerami przemysłowymi, oraz biopolimery, do których zaliczają się przede wszystkim białka, kwasy nukleinowe oraz polisacharydy[5]
Od czasu wynalezienia bakelitu, który był pierwszym syntetycznym polimerem, otrzymano bardzo wiele tworzyw sztucznych o bardzo różnych właściwościach. Do odgrywających największą rolę polimerów można zaliczyć polietylen, polipropylen, nylon, teflon, polistyren, polichlorek winylu oraz syntetyczne gumy i silikony.
Poprzez dobór odpowiednich warunków polimeryzacji można otrzymać polimery tego samego związku charakteryzujące się różną budową łańcucha. Najczęściej modyfikowane parametry to długość łańcucha, stopień rozgałęzienia oraz taktyczność[6]. Jeżeli do syntezy zostanie wykorzystany jeden związek, to powstały polimer będzie homopolimerem. Jeżeli zostaną użyte dwa związki, to produktem będzie kopolimer. Poprzez regulację ilości drugiego składnika można regulować istotne właściwości polimeru, takie jak twardość, gęstość oraz wytrzymałość mechaniczna.
Związki naturalne

Istnieje wiele klas związków naturalnych i biopolimerów, z których większość ma kluczowe znaczenie dla istnienia znanego nam życia opartego na związkach węgla. Jak wspomniano wyżej trzy podstawowe klasy biopolimerów to białka, kwasy nukleinowe oraz polisacharydy. Do podstawowych typów związków małocząsteczkowych występujących w żywych organizmach zalicza się:[7]
- Aminokwasy stanowiące bloki budulcowe dla białek. Poza 20 podstawowymi aminokwasami białkowymi istnieje ponad 100 aminokwasów nie występujących w białkach. Pełnią one różnorodną funkcję w organizmach – działają jako cząsteczki sygnałowe, stanowią intermediaty występujące w procesach metabolicznych lub biorą udział w procesach redoks.
- Cukry, nazywane także węglowodanami pełniące głównie funkcje budulcowe (pod postacią takich polisacharydów jak celuloza i chityna oraz energetyczne (stanowią podstawowy substrat w procesie glikolizy).
- Lipidy będące zróżnicowaną grupą związków stanowiących, w przypadku wielu organizmów materiał zapasowy. Ponadto fosfolipidy stanowią podstawowy budulec błony komórkowej.
- Izoprenoidy stanowią grupę związków wywodzących się od wspólnego związku, fosforanu izopentylu. W organizmach zwierzęcych największą rolę spełniają pochodne cholesterol występujący w błonie komórkowej i jego pochodne odgrywające rolę hormonów. W organizmach roślinnych występuje bardzo wiele izoprenoidów o różnorodnych funkcjach
Poza tymi głównymi klasami związków naturalnych w przyrodzie występuje wiele innych związków organicznych, których rola często nie jest dobrze poznana. Do istotnej dla ludzi grupy należą alkaloidy, często wykorzystywane w medycynie oraz do produkcji używek i narkotyków.
Reakcje związków organicznych
Różnorodność reakcji chemicznych, jakim mogą podlegać związki organiczne, jest zależna od ilości grup funkcyjnych jakie one posiadają. Przykładowo alkany są znacznie mniej reaktywne niż związki zawierające grupę karbonylową. Z powodu różnorodnej struktury i obecności wielu grup funkcyjnych przebieg reakcji i stojący za tym mechanizm jest z reguły bardziej złożony niż w przypadku reakcji związków nieorganicznych.
Do wyjaśnienia mechanizmu dowolnej reakcji organicznej należy rozważyć kilka głównych czynników mających wpływ na reaktywność i stereochemię:
- powinowactwo elektronowe
- siłę wiązań
- zawadę steryczną
- efekty stereoelektronowe
- wiązania wodorowe
- efekty rozpuszczalnikowe
Ponadto kluczowe znaczenie ma wykrycie i ustalenie struktury reaktywnych intermediatów takich jak karbokationy, karboaniony czy karbeny. Z powodu krótkiego czasu życia badania nad tymi indywiduami są utrudnione. Dopiero wykorzystanie takich technik jak femtosekundowa spektroskopia laserowa pozwoliło na dokładniejsze zrozumienie procesów związanych z rozpadaniem i tworzeniem się nowych wiązań w czasie reakcji chemicznej.
Ponieważ reakcje organiczne mają złożony przebieg, to zwykle obok głównej reakcji zachodzi też jedna lub więcej reakcji ubocznych. W niektórych przypadkach zachodzenie tych reakcji może naprowadzić badaczy na trop mechanizmu danej reakcji, jednak w większości przypadków reakcje uboczne uznawane są za procesy szkodliwe, ponieważ obniżają one wydajność powstawania właściwego produktu.
Wyznaczanie struktury związków organicznych

Z reguły cząsteczki organiczne mają skomplikowaną budowę, której nie można wyznaczyć jedynie na podstawie wzoru sumarycznego danego związku. Mimo tego, posiadając znany wzór sumaryczny można, poprzez porównanie ilości atomów wodoru i węgla wyznaczyć sumaryczną ilość nienasyconych wiązań w cząsteczce. Opierając się o te informacje nie można jednak ustalić, czy są to wiązania podwójne czy potrójne, ani wyznaczyć ich położenia w cząsteczce. Ponadto im bardziej złożona jest substancja, która jest przedmiotem badań, tym większa jest liczba potencjalnych izomerów konstytucyjnych, a także stereoizomerów.
Związki organiczne często tworzą mieszaniny. Wykorzystując różne temperatury wrzenia składników mieszaniny oraz różnice w rozpuszczalności w różnych rozpuszczalnikach można przy użyciu prostych technik takich jak destylacja, ekstrakcja oraz krystalizacja, w łatwy sposób rozdzielić proste mieszaniny. Do rozdziału mieszanin związków o podobnych właściwościach fizykochemicznych należy wykorzystać bardziej skomplikowane metody, takie jak destylacja frakcyjna, chromatografia oraz techniki elektroforetyczne.
Po rozdziale mieszaniny można przystąpić do identyfikacji poszczególnych składników. W chwili obecnej istnieje wiele technik umożliwiających ustalenie struktury związku organicznego. Poniżej zostaną zaprezentowane metody o największym znaczeniu we współczesnej chemii organicznej.
- Krystalografia rentgenowska stanowi obecnie najdokładniejszą metodę wyznaczania struktury przestrzennej związków organicznych. Jedynym ograniczeniem w jej zastosowaniu jest konieczność otrzymania dobrze wykształconego kryształu badanego związku. W przypadku niektórych związków, takich jak nukleotydy lub białka, otrzymanie kryształów jest bardzo trudne i czasochłonne, co ogranicza zastosowanie tej techniki. Jednak, mimo trudności z krystalizacją białek, krystalografia rentgenowska znajduje duże znaczenie w biologii strukturalnej do otrzymywania dokładnych struktur białek i kwasów nukleinowych. W chemii organicznej krystalografia ma decydujące znaczenie w badaniach strukturalnych związków metaloorganicznych.
- Analiza elementarna to metoda badawcza, w której próbka związku jest precyzyjnie ważona, a następnie ulega spaleniu. Na podstawie analizy pozostałości po spaleniu można wyznaczyć jakie pierwiastki wchodzą w skład badanego związku oraz jakie są zależności stechiometryczne pomiędzy nimi. Obecnie metoda ma ta znaczenie marginalne, głównie z uwagi na bardzo szybki rozwój spektrometrii mas (patrz poniżej).
- Spektrometria mas stanowi najdokładniejszą metodę wyznaczania mas związków chemicznych. Metoda ta polega na jonizacji próbki zawierającej pojedynczą substancję lub ich mieszaninę, a następnie pomiarze masy powstałych jonów. Poprzez bardzo precyzyjne wyznaczenie masy cząsteczki oraz wykorzystanie dodatkowych informacji możliwych do uzyskania za pomocą tej techniki (wzory fragmentacji jonów) można wyznaczyć wzór sumaryczny badanego związku, a także uzyskać pewne informacje na temat jego struktury.
- Techniki spektroskopowe stanowią bardzo uniwersalne narzędzie do identyfikacji związków organicznych. Podstawową ideą spektroskopii jest wykorzystanie oddziaływań fal elektromagnetycznych z cząsteczkami związków chemicznych do uzyskania informacji na temat budowy tych molekuł. Obecnie mają one największe zastosowanie spośród wszystkich stosowanych w chemii organicznej metod fizykochemicznych. Istnieje wiele typów metod spektroskopowych, z których w chemii organicznej największe zastosowanie mają[8]:
- Spektroskopia NMR obecnie odgrywa ona dominującą rolę w identyfikacji związków organicznych. W ramach NMR istnieje bardzo wiele technik, których umiejętne użycie pozwala na wyznaczenie wzoru strukturalnego zasadniczo każdego związku małocząsteczkowego. Ponadto pozwala ona na badanie mechanizmów reakcji chemicznych, wyznaczanie składu mieszanin, a także ustalanie budowy przestrzennej białek i kwasów nukleinowych.
- Spektroskopia w podczerwieni technika ta pozwala na wykrycie podstawowych grup funkcyjnych w cząsteczce, a także badanie wiązań wodorowych oraz ustalanie składu mieszanin organicznych.
- Spektroskopia Ramana, podobnie jak spektroskopia w podczerwieni, pozwala na wykrywanie grup funkcyjnych w związkach organicznych, znajduje ona także liczne zastosowania w badaniach związków zaadsorbowanych na powierzchniach.
- Spektroskopia UV-VIS stosowana jest głównie do ustalania stężeń związków w roztworach, a także badań przejść elektronowych. Ten rodzaj spektroskopii nie odgrywa dużego znaczenia w bezpośredniej identyfikacji związków organicznych.
- Dichroizm kołowy to najczęściej stosowana obecnie metoda chiralooptyczna znajdująca zastosowanie w badaniach związków czynnych optycznie.
Syntetyczna chemia organiczna

Syntetyczna chemia organiczna, nazywana często po prostu syntezą organiczną, stanowi naukę stosowaną zajmującą się projektowaniem i prowadzeniem syntez złożonych cząsteczek organicznych.
W większości przypadków zaprojektowanie efektywnej syntezy nowego związku chemicznego stanowi duży problem z uwagi na ogromną liczbę możliwych dróg prowadzących od substratów do cząsteczki docelowej. Nie zawsze możliwe jest ustalenie jednej optymalnej strategii syntezy, ponadto w wielu przypadkach nie można przewidzieć czy w danych warunkach określona reakcja będzie zachodziła z dobrą wydajnością. Mimo tego istnieje kilka zasadniczych reguł, którymi należy się kierować przy projektowaniu syntezy, takich jak redukcja ilości kroków syntetycznych poprzez prowadzenie równoległej syntezy kilku bloków syntetycznych. W wielu przypadkach, zwłaszcza przy prowadzeniu syntez totalnych, istnieje konieczność zmodyfikowania lub opracowania nowych procedur syntetycznych.
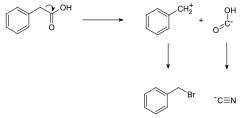
Obecna metodologia projektowania syntez opiera się na koncepcji analizy retrosyntetycznej opracowania przez E. J. Coreya. Stanowi ona niejako odwrócenie klasycznej syntezy, ponieważ polega na rozbiciu cząsteczki docelowego związku na szereg mniejszych elementów nazywanych syntonami, które stanowią ekwiwalenty rzeczywistych produktów pośrednich występujących w danej syntezie. Poprzez stopniowe rozbijanie złożonych syntonów dochodzi się do etapu, w którym dalsze uproszczenie struktury nie jest już możliwe. Wtedy należy zamienić syntony na odpowiadające im rzeczywiste substraty. Dla cząsteczek o bardzo skomplikowanej budowie, takich jak taksol, ilość potencjalnych drzew retrosyntetycznych jest bardzo duża. W takim przypadku często wykorzystuje się odpowiednie programy komputerowe przyśpieszające wybór efektywnej drogi syntezy.
Podstawowe zagadnienia chemii organicznej
- Organiczne grupy funkcyjne
- Mechanizmy reakcji chemicznych
- Stereochemia
- Synteza organiczna a zwłaszcza synteza asymetryczna
Specjalistyczne działy chemii organicznej
Przypisy
- ↑ Robert T. Morrison, Robert N. Boyd, and Robert K. Boyd, Organic Chemistry, 6th edition (Benjamin Cummings, 1992, ISBN 0-13-643669-2)
- ↑ John D. Roberts, Marjorie C. Caserio, Basic Principles of Organic Chemistry, (W.A. Benjamin,Inc., 1964)
- ↑ Richard F. and Sally J. Daley, Organic Chemistry, http://www.ochem4free.info
- ↑ E. J. Corey, X-M. Cheng: The Logic of Chemical Synthesis. Wiley New York, 1995. ISBN 0-471-11594-0.
- ↑ "industrial polymers, chemistry of." Encyclopædia Britannica. 2006
- ↑ Stevens, Malcolm P., Wprowadzenie do chemii polimerów tł. zbiorowe z ang. pod red. Mirosława Włodarczyka, Warszawa : Państ. Wydaw. Naukowe, 1983, ISBN 83-01-03110-7
- ↑ A. Kołodziejczyk, Naturalne związki organiczne,Wydawnictwo Naukowe PWN 2006, ISBN 83-01-14316-9
- ↑ W. Zieliński, A. Rajca (red.), Metody spektroskopowe i ich zastosowanie do identyfikacji związków organicznych, WNT, Warszawa, 2000
Linki zewnętrzne
- Podręcznik "Organic Chemistry On Line"
- "Vortal Młodego Chemika"
- "Chemia Organiczna OnLine"
- MIT OpenCourseWare: Organic Chemistry I. ocw.mit.edu. [zarchiwizowane z tego adresu (2007-04-21)].
- Wykłady z chemii organicznej
- Journal of Organic Chemistry (wymagana subskrypcja) (Spis treści)
- Organic Letters (Spis treści)
- Synlett. thieme-connect.com. [zarchiwizowane z tego adresu (2008-01-24)].
- Synthesis. thieme-connect.com. [zarchiwizowane z tego adresu (2009-01-19)].
- Organic Chemistry Portal
- zbiór tekstów poświęconych chemii organicznej
- Podręcznik chemii organicznej
- Organic Chemistry Resources WorldWide – zbiór przydatnych linków
- Klasyfikacja związków organicznych i grup funkcyjnych. library.thinkquest.org. [zarchiwizowane z tego adresu (2009-02-26)].
- Roger Frost's Organic Chemistry - różnorodne pomoce multimedialne
- Organic chemistry help
- Organic Chemistry Tutor
- Chemiczny Freeware na http://www.acdlabs.com
- Chemiczny Freeware. chemaxon.com. [zarchiwizowane z tego adresu (2010-01-20)]. oferowany przez ChemAxon.
- Organic chemistry help-Best of the Web 2008. aceorganicchem.com. [zarchiwizowane z tego adresu (2010-01-23)].
- Zbiór różnorodnych zasobów sieciowych poświęconych chemii organicznej. orgcheminfo.8k.com. [zarchiwizowane z tego adresu (2010-06-16)].
Media użyte na tej stronie
Ball-and-stick model of part of a poly(difluorophosphazene) chain, (NPF2)n, from the crystal structure of the polymer.
Colour code:
- Phosphorus, P: orange
- Nitrogen, N: blue
- Fluorine, F: yellow-green
Crystal structure by X-ray diffraction from Inorg. Chem. (1972) 11 1120–1123
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.Autor: DynaBlast, Licencja: CC BY-SA 2.5
Covalently bonded hydrogen and carbon in a w:molecule of methane.
Acetic acid with all atoms drawn, in a realistic conformation.
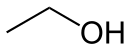
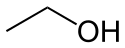
Ball-and-stick model of the ethanol molecule, C2H6O.
Structural information (determined by microwave spectroscopy) from CRC Handbook, 88th edition.
Image generated in Accelrys DS Visualizer.Autor: User V8rik on en.wikipedia, Licencja: CC-BY-SA-3.0
Opis
Corey oseltamivir synthesisA possible structural diagram for Benzene.
Autor: Vladsinger, Licencja: CC BY-SA 3.0
Orbital hybridization in benzene rings.
Autor: Effeietsanders, Licencja: CC BY-SA 2.5
Cafeïne-molecuul. Rood = zuurstof, lichtblau = koolstof, donkerblauw = stikstof, wit = waterstof
Ethanol chemical structure
Retrosynthesis of phenylacetic acid to give the synthons, benzyl bromide and sodium cyanide